DNA veranderen met CRISPR-CAS9: ethisch aspect gentherapie
 Sinds de ontdekking van CRISPR-CAS9 is het mogelijk om genen snel, goedkoop en gericht te veranderen. Hierdoor kunnen genetische ziekten in theorie worden voorkomen en genezen. En dat is goed nieuws. Maar er kleven ook beperkingen aan en risico's en bedreigingen. De 'maakbare mens' ligt hierdoor op de loer. Ook een gezond lichaam kun je door CRISPR-CAS9 veranderen ofwel verbeteren. De twee onderzoekers ontvingen de Nobelprijs voor Scheikunde in 2020 voor hun ontdekking van deze techniek.
Sinds de ontdekking van CRISPR-CAS9 is het mogelijk om genen snel, goedkoop en gericht te veranderen. Hierdoor kunnen genetische ziekten in theorie worden voorkomen en genezen. En dat is goed nieuws. Maar er kleven ook beperkingen aan en risico's en bedreigingen. De 'maakbare mens' ligt hierdoor op de loer. Ook een gezond lichaam kun je door CRISPR-CAS9 veranderen ofwel verbeteren. De twee onderzoekers ontvingen de Nobelprijs voor Scheikunde in 2020 voor hun ontdekking van deze techniek.- Genetische aandoeningen
- Wat is DNA?
- De ontdekking van de structuur van DNA
- Wat doet DNA?
- Waaruit bestaat DNA?
- Het lezen van DNA met RNA
- Genen en chromosomen
- Wat weten we nog niet over DNA?
- DNA bewerken
- Wat is CRISPR/CAS9
- De ontdekkers van CRISPR/CAS9
- Wat doet CRISPR/CAS9
- CRISPR/CAS9 in ontwikkeling
- Wat levert CRISPR/CAS9 op?
- Wat betekent CRISPR/CAS9 voor de mens?
- Zijn er (al) nadelen bekend?
- De mogelijkheden van CRISPR-CAS9
- De bedreigingen van CRISPR-CAS9?
- Wat mag er volgens de wet?
- Meer onderzoek en meer debat
Genetische aandoeningen
Er zijn verschillende soorten genetische aandoeningen.Erfelijke genetische aandoeningen
Inmiddels is er al veel bereikt op het gebied van het inzicht en de bestrijding van bacteriële infecties en virussen. Er zijn geneesmiddelen, antibiotica en vaccins beschikbaar die helpen om deze ziekten te bestrijden. Dit proces heeft honderden jaren geduurd. Voor genetische aandoeningen zijn we nog niet zo ver. Genetische ziekten zijn aandoeningen die door genmutaties van de ene op de andere generatie worden doorgegeven. Het kan gaan om erfelijke ziekten door afwijkingen in de genen of chromosomen. Er zijn vele duizenden genetische of gedeeltelijk genetische aandoeningen, door afwijkingen in het menselijk DNA, die in de familie kunnen zitten. Deze zijn lang niet allemaal even ernstig gelukkig. Voor de genezing van genetische aandoeningen, zoals taaislijmziekte, sikkelcelanemie, de ziekte van Huntington, maar ook astma en kleurenblindheid is nog veel kennis en onderzoek nodig (oktober 2020).
Verworven genetische aandoeningen
Er zijn ook genetische aandoeningen die pas later in het leven ontstaan, wanneer er schade ontstaat aan voorheen onbeschadigd genetisch materiaal. Deze soort noemen we verworven genetische aandoeningen. DNA kan muteren (door zogenaamde mutagenen) als gevolg van factoren, zoals omstandigheden (zonlicht, radioactiviteit), levensstijl (roken) en leeftijd bijvoorbeeld, maar kan ook spontaan muteren bij het overschrijven het DNA bij de celdeling. Hierdoor kunnen deze verworven genetische aandoeningen ontstaan.
Kanker
Ook kanker ontstaat als gevolg van genmutaties. Hiervan is maar ongeveer 5% erfelijk.
Door technologische en wetenschappelijke ontwikkelingen zoals CRISPR/CAS9 komt menselijk ingrijpen in genetische aandoeningen en het voorkomen of genezen ervan steeds dichterbij. Hierdoor ontstaan veel kansen, maar ook risico's. Waar staan we anno 2020?
Wat is DNA?
Johann Friedrich Miescher ontdekte in 1869 bij de bestudering van witte bloedcellen, dat celkernen een fosforhoudende stof bevatten en noemde dit nucleïne, het latere DNA. DNA is een afkorting van deoxyribonucleid acid ofwel in het Nederlands: desoxyribonucleïnezuur. Bij eucaryoten, zoals de mens, bevat de celkern (van iedere cel) onder meer het molecuul DNA. Bij procaryoten, zoals bacteriën en eencellige micro-organismen, ligt het DNA vrij in het cytoplasma, dat met de celkern, omgeven wordt door de celwand.De ontdekking van de structuur van DNA
Dat er zoiets als DNA bestond was dus al bekend, toen in 1953 moleculair bioloog James Watson met Francis Crick, Rosalind Franklin en Maurice Wilkins de structuur van DNA ontdekten. Zij kwamen erachter dat DNA de vorm van een dubbele helix heeft. Watson en Crick kregen er in 1962 de nobelprijs voor de Fysiologie of Geneeskunde voor.Wat doet DNA?
In het DNA zit alle erfelijke (of genetische) informatie. Dit is zo in alle levende organismen (inclusief virussen, maar met uitzondering van RNA-virussen). Dit DNA is het bouwplan, de instructiehandleiding voor de aanmaak van eiwitten. Voor elke functie (en eigenschap) van een cel is een gegeven eiwitstructuur nodig. Vandaar ook dat DNA zo belangrijk is; een klein foutje kan een groot verschil maken.Het DNA wordt gedragen door de nucleosomen, die zijn opgebouwd uit eiwitten, zogenaamde histonen. Deze histonen zorgen voor condensatie van het DNA, zodat het kan worden 'opgevouwen' en in de celkern past. Anders zou het alles bij elkaar kilometerslang zijn en onleesbaar worden. DNA is overal in je hele lijf hetzelfde. Dus of je het nu uit je bloed of je wangslijmvlies haalt maakt niets uit. In iedere lichaamscel zit hetzelfde DNA.
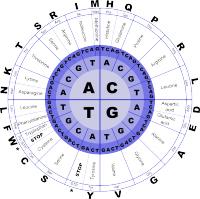
Waaruit bestaat DNA?
Een DNA-molecuul ziet eruit als een dubbele helix. Een soort van wenteltrap. Het DNA bestaat uit nucleotiden, de bouwstenen. In het DNA zitten vier verschillende nucleotiden met de nucleobasen adenine, thymine, guanine en cytosine, die afgekort worden met respectievelijk de letters A, T, G en C. Het gaat in feite dus om een soort 'organische' wenteltrap van twee strengen, die met elkaar zijn verbonden door zogenaamde (nucleo)baseparen. Dit zijn de treden van de wenteltrap, zou je kunnen zeggen. Alleen de paren AT en GC kunnen voorkomen. De twee strengen zijn daarmee complementair. Dat betekent ook dat als je de ene letter weet, je ook de andere weet. Hierdoor heb je ook meteen een mogelijk kopieermechanisme. Als de treden gevormd worden door zo'n paar van nucleobasen, worden de leuningen van de wenteltrap gevormd door: desoxyribose (ook wel deoxyribose genoemd, een monosacharide of suikermolecuul) en trifosfaat. Drie opeenvolgende basen binnen het DNA vormen een codon of triplet.De volgorde van deze nucleotiden wordt een sequentie genoemd. Een gen is een aantal letters achterelkaar en bevat het recept, de specifieke code voor het maken van een eiwit. De unieke sequentie of volgorde van deze nucleotiden wordt een genetische code, het genotype van een organisme, genoemd.
Veel DNA-onderzoek maakt gebruik van sequencen; het bepalen van de volgorde van de bouwstenen oftewel de DNA-code uit de witte bloedcellen. Dit gaat veel sneller en is veel goedkoper dan vroeger. We noemen dit type DNA-onderzoek ‘Next Generation Sequencing’ (NGS). Je kunt zo een specifiek gen, een aantal genen (een 'genpanel) of het hele DNA onderzoeken. Bijvoorbeeld om te zien of het afwijkt van de 'normale' code en er dus sprake is van een erfelijke ziekte.
 Bron: OpenClipart Vectors, Pixabay
Bron: OpenClipart Vectors, PixabayHet lezen van DNA met RNA
Om de DNA-code in een cel te kunnen lezen zijn eiwitten nodig. Voor de aanmaak van deze eiwitten is RNA (ribonucleic acid ofwel ribonucleïnezuur) nodig. RNA wordt de hele tijd afgebroken en weer gemaakt, in tegenstelling tot DNA dat in een vaste hoeveelheid als chromosomen in de cel voorkomt. RNA is net als DNA opgebouwd uit een (meestal enkelstrengige) keten van nucleotiden, maar bevat in plaats van thymine uracil (U) en ribose in plaats van desoxyribose. Er zijn diverse soorten RNA met elk verschillende functies.RNA zorgt voor een netwerk van eiwitten die het DNA coderen, lezen, vertalen en transporteren. RNA kopieert het DNA en zet deze DNA-code van letters (A, T, G, C) om naar de RNA lettercode (A, U, G, C), zodat het gelezen kan worden en vertaalt het met behulp van RNA polymerase naar boodschapper- of messengerRNA (mRNA). Dit proces heet transcriptie. Dit mRNA, met de code voor een eiwit wordt vervoerd naar het cytoplasma. Dit gebeurt met transferRNA (tRNA), dat zich bindt met het mRNA.
Een ribosoom maakt verbinding met het tRNA en leest de mRNA-streng (messenger-RNA) per drie basen (dus per codon). Het ribosoom vertaalt de codon in een aminozuur. Een reeks van aminozuren vormt samen een eiwit. 64 codons coderen voor 20 verschillende aminozuren. Aminozuren zijn de bouwstenen voor de eiwitten die de cel gaat maken. Dit proces waarin DNA via RNA met behulp van de ribosomen omgezet wordt naar een werkzaam eiwit heet translatie (vertaling). Met de eiwitten worden weer cellen gebouwd. Cellen zijn de bouwstenen voor weefsel, weefsels vormen organen, organen vormen organenstelsels en die vormen tezamen een organisme.
Genen en chromosomen
De genen bevinden zich in een chromosoom, een eiwitstructuur in de celkern. Een chromosoom is ook weer opgebouwd uit DNA. En hoewel het DNA zelf dus niets doet, maar al het werk overlaat aan de eiwitten, bepaalt het DNA wel hoe het chromosoom eruitziet. Een chromosoom bevat honderden genen. Mensen hebben 46 chromosomen in elke celkern, in 23 paren: 23 van je vader en 23 van je moeder. Uitzondering hierop zijn de geslachtscellen, ofwel de eicellen en spermacellen, die alleen de eigen 23 chromosomen bevatten. Hierdoor zorgen ze bij de bevruchting voor cellen met (2x23=) 46 chromosomen in het nageslacht. Van de 46 chromosomen zijn er 2 de geslachtsshormonen: twee X-chromosomen voor vrouwen, een X- en een Y-chromosoom voor mannen. De 44 andere chromosomen heten autosomale chromosomen. Alle chromosomen samen noemen we chromatide, de kernstof. Al het DNA in je hele lijf samen wordt een genoom genoemd. Dit genoom maakt je uniek, want hoewel voor 99,9% hetzelfde, maakt juist die kleine variatie het heel persoonlijk. In totaal heeft een mens zo'n 20.000-30.000 genen. Schattingen hiervoor lopen uiteen. Door overerving of door omstandigheden tijdens het leven kunnen foutjes of veranderingen ontstaan in de genen of chromosomen. Hierdoor kunnen genetische aandoeningen ontstaan. Bron: 3dman Eu, Pixabay
Bron: 3dman Eu, PixabayWat weten we nog niet over DNA?
Er is nog veel onbekend als het gaat om DNA. Zo heeft maar ongeveer 1 à 2% van ons DNA een eiwitcoderende werking. In totaal heeft ongeveer 10% van ons DNA een bekende functie, waaronder bijvoorbeeld het reguleren van andere genen. Deze liggen verspreid tussen het vele 'junk-DNA' (ofwel afval-DNA), waarvan de functie nog onbekend is. In 2012 was de uitkomst van een groot ENCODE-onderzoek dat veel afval-DNA wel een functie heeft, waarmee ze meenden te hebben aangetoond dat 80% van het menselijk genoom functioneel is. Dit onderzoeksresultaat is sindsdien zwaar bekritiseerd. Nu, in 2020, gaan we ervan uit dat veel van het niet-coderend DNA geen directe functie heeft. Het bestaat uit herhaalde DNA-sequenties: stukjes DNA die als kopie aanwezig zijn in het genoom, waarvan nog eens meer dan de helft bestaat uit transposons: DNA dat binnen een cel kan bewegen. Toch is het evolutionair gezien misschien ook functioneel om een groot deel van het DNA geen directe functie te geven. Gaat er eens iets fout bij de celdeling dan is de kans dat het een gen betreft met een belangrijke functie voor het lichaam ook maar klein. Bovendien blijkt bijvoorbeeld uit promotieonderzoek van Dudek (november 2018) aan de Radboud Universiteit dat niet-coderende RNAs als marker zouden kunnen fungeren om het stadium van (blaas)kanker te bepalen of het verloop van de ziekte en de reactie op chemotherapie te kunnen voorspellen.DNA bewerken
Het was al mogelijk om DNA aan te passen. Allereerst al sinds duizenden jaren door veredeling, van hondenrassen bijvoorbeeld of tarwe. Zonder precies te weten hoe het werkte, konden mensen de groei en ontwikkeling van gewassen en dieren zo beïnvloeden. Na de ontdekking van de structuur van DNA werd bewust geprobeerd om genmutaties te bewerkstelligen. Bijvoorbeeld door gewassen met radioactieve straling proberen te veranderen, of chemicaliën, als insuline en groeihormoon, te ontwikkelen met gentherapie. Maar dit was vaak tijdrovend werk en weinig precies. De ontdekking van CRISPR/CAS9 veranderde dat.Wat is CRISPR/CAS9
CRISPR staat voor Clustered regularly interspaced short palindromic repeats. CRISPR's zijn korte stukjes van herhaalde codes in het DNA die een bacterie of virus gebruikt als afweermechanisme om een nieuwe virusaanval te herkennen. Het is een sequentie die je vooruit hetzelfde spelt als achteruit en daardoor makkelijk is terug te vinden. Met CRISPR kun je relatief gemakkelijk genen bewerken door heel precies in DNA te knippen.De ontdekkers van CRISPR/CAS9
In 2012 waren Jennifer Doudna, assistent-professor aan de universiteit van Berkely in California in de V.S. en Emmanuelle Charpentier, directeur van het Max Planck instituut voor Infectie Biologie in Berlijn in Duitsland, een van de eersten om de mogelijkheden hiervan te zien en ontvingen voor hun onderzoek naar het veranderen van stukjes DNA in een gen gezamenlijk de nobelprijs voor Scheikunde in 2020. Voor het eerst in de geschiedenis werd deze prijs uitgereikt aan twee vrouwen. Een geweldig eerbetoon voor een geweldige prestatie.Jennifer Doudna en Emmanuelle Charpentier hebben deze methode in 2012 ontwikkeld nadat ze ontdekten dat sommige (oer)bacteriën en virussen (bacteriophagen) een adaptief immuunsysteem hebben, waardoor ze uit zelfbescherming door DNA heen konden snijden. Zij behielden de stukjes van het virus-DNA van eerdere aanvallen (CRISPR wordt dan ook wel gezien als een enorme DNA-bibliotheek met stukjes eigen DNA-code en stukjes virus-DNA). Wanneer de bacterie werd aangevallen met een virus waar hij al eerder mee in contact is gekomen, gebruikte het een enzym (een bepaald eiwit CAS, ofwel een CRISPR Associated Sequences) om het virus DNA te vinden en weg te knippen. Door deze methode aan te passen kunnen genen van elk organisme op deze manier worden bewerkt.
Wat doet CRISPR/CAS9
Het CRISPR/CAS9-systeem is verantwoordelijk voor twee dingen;[OLIST]CRISPR zoekt in het genetisch materiaal van een bepaalde cel naar een specifieke DNA-sequentie (dus een gegeven volgorde van de letters A, T, G en C). Je kunt het vergelijken met een enorme DNA-bibliotheek van korte stukjes eigen DNA en DNA van agressieve virussen (Spacer DNA). Hiervoor is een kopie van de te zoeken DNA-sequentie ofwel een gids-RNA nodig, waarmee het CAS9-enzym wordt geleid naar deze specifieke plek. De kwaliteit van het gidsRNA (gRNA) en de 'doelcel' bepalen hoe precies de knip wordt.
Zodra er een match is, en de DNA-sequentie dus is gevonden, knipt het CAS9-eiwit het DNA dat het zocht.[/OLIST]
Er zijn ook andere enzymen die voor deze techniek gebruikt kunnen worden, zoals Cpf1, maar CAS9 wordt het meest gebruikt. Vandaar de naam: CRISPR/CAS9.
CRISPR/CAS9 in ontwikkeling
CRISPR/CAS9 gaf de mogelijkheid om zo'n 10% van het genoom te bereiken. Dit kwam omdat het gebruikte enzym spCAS9 twee G nucleotiden nodig heeft om de bestemming te herkennen (de PAM code; protospacer adjacent motif). Door nieuwe analysesoftware en het gebruik van het natuurlijke enzym scCAS9 in plaats van spCAS9 hebben wetenschappers aan het M.I.T. (Massachusetts Institute of Technology) in de Verenigde Staten dit kunnen verhogen naar 50%. spCAS9 heeft namelijk maar een G nucleotide nodig en daarmee is het bereik ineens een stuk groter geworden. Zo is CRISPR/CAS9 weer verder geoptimaliseerd. Ook dit enzym maakt gebruik van hetzelfde gidsRNA en het is de verwachting dat deze manier van toepassen van CRISPR/CAS9 wereldwijd snel navolging zal vinden.Wat levert CRISPR/CAS9 op?
Wanneer het DNA is geknipt, repareert de cel zichzelf door:- de twee uiteindes van de knip met elkaar te verbinden, waarbij een beetje DNA verloren gaat om een precieze aansluiting te garanderen. De originele functie van het gen wordt hierdoor verstoord. Dit heet: Non Homologous End Joining (NHEJ).
- beschikbaar DNA te gebruiken om het door het knippen ontstane gat te dichten. Dit wordt Homology Directed Repair (HDR) genoemd.
Door het herstelproces na de knip van de cel naar goed inzicht te gebruiken, en daarmee het DNA dus te veranderen, kunnen wetenschappers de cel veranderen. Dit kan door CRISPR/CAS9 snel, relatief eenvoudig en goedkoop.
Wetenschappers kunnen op twee manieren deze 'genome editing' toepassen:
[OLIST]Door een of enkele nucleotiden van het DNA met een heel specifiek vooropgezet doel te veranderen. De verandering blijft dan beperkt en lijkt op klassieke of natuurlijke genmutagenese methoden, zoals veredeling of genmutatie door straling.
Door nieuw DNA (van een paar baseparen tot enkele genen) in te bouwen in het genoom. Dit lijkt op genetische modificatietechnieken, zoals de recombinanttechniek, waarbij een RNA- of DNA-virus met de gewenste DNA-code als een vector, een transporteur, wordt gebruikt naar de gastheercel die, wanneer hij zichzelf gaat delen, vanzelf het nieuwe DNA zal aanmaken.[/OLIST]
Wat betekent CRISPR/CAS9 voor de mens?
Voor de humane geneeskunde kun je onderscheid maken tussen gentherapie, zoals CRIPSR/CAS9, in somatische cellen en in kiembaanmutaties. Gaat het om DNA-aanpassingen in het eerste geval, dan gebeurt dit zonder dat mutaties op een volgende generatie worden overgebracht. Doel kan zijn om ziekten (waaronder ook kanker) te behandelen, maar het kan ook om preventieve toepassingen, zoals het voorkomen van infecties of genetische doping, gaan. Met name in het laatste geval is het nodig dat een discussie hierover op gang komt over wat we wel of niet ethisch vinden en wat voor soort regulering er nodig is.Gaat het om kiembaanmutaties, dat wil zeggen veranderingen van DNA in stamcellen, geslachtscellen of embryo’s, dan is meer medisch-inhoudelijk onderzoek en een breed maatschappelijk debat nodig, om ook de ethische implicaties te overwegen. Veranderingen in kiembaanmutaties of erfelijke mutaties zijn nu nog wereldwijd strikt aan banden gelegd, maar de eventuele mogelijkheden lijken eindeloos.
Designer baby's?
Op 25 november 2018 kondigde de Chinese wetenschapper He Jiankui via YouTube aan dat hij met behulp van CRISPR-CAS9 bij twee embryo's een aanpassing heeft gedaan in het DNA van de bevruchte eicel meteen na een ivf-behandeling. De tweeling Lulu en Nana zouden de eerste genetisch gemodificeerde baby's ter wereld zijn. Zijn bedoeling was om ervoor te zorgen dat de kinderen resistent tegen HIV zouden worden door met CRISPR-CAS9 de genen (te weten het gen: CCR5) aan te passen. Of dit ook daadwerkelijk het geval is, is nog niet verder onderzocht en moet de toekomst uitwijzen (stand van zaken begin oktober 2020). Het was de dag waarvan je wist dat hij zou komen, zo gaf Jennifer Doudna al aan, maar dan wel op een van de ergst denkbare manieren.
De wetenschappelijke wereld laakte het ondoorzichtige, onethische en onzorgvuldige optreden van He Jiankui. Wetenschappers vonden het schandelijk dat hij gezonde baby's heeft gebruikt voor een onnodig onderzoek (zonder 100% garantie dat de baby's inderdaad HIV-resistent zijn), dat de methode niet precies genoeg is toegepast, dat het onderzoek niet nauw is gemonitord en dat er geen afstemming en controle is geweest van collega-wetenschappers. Daarbij heeft hij mogelijk de betrokken ouders niet goed voorgelicht, de universiteit en vakgenoten waar hij voor werkte niet of onvoldoende ingelicht en heeft hij zich niet gehouden aan de consensus die over de hele wereld er zowel wetenschappelijk als maatschappelijk geldt.
Het gevaar dat een klein groepje wetenschappers op eigen houtje gaat experimenteren met de CRISPR-CAS9 techniek is helaas reëel gebleken, maar ook is duidelijk van veel wetenschappers zich wel aan de geldende normen houden. Ondanks dat (of dankzij) er nog zoveel onbekend is over deze techniek.
Zijn er (al) nadelen bekend?
Kunnen we de risico's en eventuele bijwerkingen van genmutaties inventariseren? Is het effect van CRISPR-CAS9 bijvoorbeeld duurzaam? Wat is de kans op een immuunrespons, waardoor het lichaam antistoffen zou kunnen aanmaken tegen de 'indringer'?Base editing (BE) is een nieuwe variant ofwel CRIPSR 2.0. Door nog een enzym aan het Cas enzym te plakken hoef je maar één van de twee DNA-strengen door te knippen, terwijl je de andere heel specifiek aanpast. De doorgeknipte streng kan zich dan naar het voorbeeld van de verbeterde streng weer herstellen. Hierdoor kun je de reparatiesystemen van het DNA omzeilen, maar dit kan niet in alle gevallen worden toegepast. Het zal CRISPR-CAS9 dus niet zozeer vervangen, maar kan wel aanvullend werken, bijvoorbeeld in geval van bepaalde puntmutatie in het menselijk genoom.
De mogelijkheden van CRISPR-CAS9
Door goede genen te knippen en deze in andere cellen in te bouwen kun je gewassen veredelen. Of door foute genen in het DNA weg te knippen, kun je genetische ziekten voorkomen of genezen. Vooropgesteld dat we de werking van de genen begrijpen en weten welke rol ze spelen in bepaalde aandoeningen of eigenschappen. En dat is nog lang niet altijd duidelijk. De rol van genen is belangrijk, maar zegt niet alles. Anders zouden bijvoorbeeld eeneiige tweelingen wel een exacte kopie van elkaar zijn, maar dat is niet zo. Een aantal van de genetische ziekten is monogeen. Dat betekent dat mutaties in een enkel gen verantwoordelijk zijn voor de ziekte. Andere genetische ziekten zijn multifactorieel, dat wil zeggen dat er sprake is van een samenspel van verschillende genvariaties. Deze zijn op zichzelf misschien niet per se erg schadelijk, maar in een bepaalde combinatie zorgen ze ervoor dat genen minder of anders functioneren en we ziek kunnen worden. Epigenetische variaties spelen een rol bij de individuele verschillen in het al dan niet ziek worden en het verloop van een ziekte. Epigenetische variatie is de vertaling van genetische eigenschappen, het DNA, naar het functioneren van cellen en organismen. Er is dus veel nog niet bekend en veel is ook niet zo simpel als het misschien op het eerste gezicht lijkt. Als we niet precies weten wat we doen is het modificeren van genen een ondoenlijke of gevaarlijke onderneming. Vandaar ook dat juist CRISPR-CAS9 veel potentie heeft, omdat het zo gemakkelijk in een onderzoekssetting gebruikt kan worden. Hierdoor is het mogelijk snel veel inzicht te krijgen. De techniek wordt breed gebruikt. En niet alleen onder professoren. Ook studenten bijvoorbeeld kunnen deze methode gebruiken tijdens hun afstudeeronderzoek. Het is dus zeker niet alleen voor klinisch onderzoek geschikt, waarbij wordt getest op menselijke proefpersonen. Door op deze manier makkelijk en relatief goedkoop onderzoek te doen naar de werking en combinatie van genen, kun je het inzicht hierin versnellen. En dat is een belangrijke eerste stap naar veranderingen in de praktijk.De bedreigingen van CRISPR-CAS9?
Grote verantwoordelijkheidDe mogelijkheden van CRISPR-CAS9 brengen ook een grote verantwoordelijkheid met zich mee. "With great power comes great responsibility", zo wist de genetisch verbeterde Spiderman al te vertellen (al is de uitspraak zelf veel ouder). Door ziekmakende genen weg te halen, kan mensen en hun nageslacht veel lijden bespaard blijven. Dit is iets wat veel mensen willen. Maar er is ook een keerzijde.
De natuur verbeteren?
De weg lijkt ook vrij naar designer baby's, gendoping en verregaande genetisch gemodificeerde dieren en planten om maar iets te noemen. Zoals glutenvrije tarwe of gewassen die extreem goed tegen droogte kunnen door genetische modificatie. Zo kun je de honger in de wereld verhelpen. Je zou muggen resistent kunnen maken tegen malaria. Of je bent ook in staat om het DNA van mensen zo aan te passen, dat ze mogelijk niet alleen beter worden, maar verbeterd worden. Kortom: de maakbare mens is binnen handbereik. Door superspieren, superhersenen, een oogkleur die het blauw van de zee bij een zonsopkomst in Scheveningen weerspiegelt? Of varkens die toekunnen met minder eten, maar wel vetgemest kunnen worden? Is dat wenselijk?
In zijn laatst verschenen boek voor zijn dood waarschuwt kosmoloog Stephen Hawking voor de toepassing van technologieën als CRISPR-CAS9. Hij ziet het gevaar van het ontstaan van een bovenklasse en onderklasse van mensen: mensen die genetisch verbeterd zijn ('supermensen') en mensen die dat niet zijn. Is dat denkbeeld gerechtvaardigd? En zo ja, wat vinden we er dan van? En is het mogelijk te voorkomen?
Wat mag er volgens de wet?
Het Hof van Justitie van de Europese Unie heeft besloten dat een biotechnologische methode als CRISPR-CAS9 valt onder de GGO-richtlijnen (ofwel richtlijnen voor genetisch gemodificeerde organismen), omdat zij deze techniek zien als genmutatie (25 juli 2018). Dit betekent dat er vooralsnog geen nieuwe wetgeving komt en dat gemodificeerde organismen pas na een lang en ingewikkeld traject kunnen worden toegelaten op de markt. Voor een deel valt dit te verklaren, omdat er veel geplakt en geknipt kan worden uit DNA met CRISPR-CAS9. Een goede risicobeoordeling is dan belangrijk. Voor een ander deel zouden de regels minder streng kunnen worden wanneer deze techniek wordt toegepast als een snelle manier van veredeling bijvoorbeeld en er geen soortengrenzen worden overschreden. En het belang van mens en milieu voorop blijven staan.Helaas blijkt dat deze beslissing ervoor zorgt dat het onderzoeks- en vestigingsklimaat hierdoor ernstig wordt aangetast: veredelingsbedrijven trekken weg uit Europa, of besluiten af te zien van CRISPR-CAS9 als veredelingsmethode en onderzoeksopdrachten aan onder meer de WUR (Wageningen University & Research) moeten worden teruggetrokken. Dit zet Europa mogelijk op achterstand. In de Verenigde Staten en in Japan wordt er anders dan in Europa tegen een mutagenesetechniek als CRISPR-CAS9 aangekeken en mag er veel meer worden geëxperimenteerd. Hier zou je de vraag kunnen stellen of een dergelijk verschil noodzakelijk en wenselijk is.
In het huidige regeerakkoord staat dat het kabinet zich sterk zal maken voor de toepassing van veredelingstechnieken als CRISPR-CAS9, mits geen soortengrenzen worden overschreden. Doel is onder meer dat de agrarische sector haar sterke internationale positie kan behouden. Minister Schouten beloofde dan ook al in 2018 om te onderzoeken of er toch ruimte is om te experimenteren met CRISPR-CAS9. Hiervoor is echter steun nodig in Europa door de uitspraak van het Europese Hof van Justitie en daar zit nog maar weinig vooruitgang in.
Hebben we als mens, als maatschappij, als wereldbevolking wel genoeg tijd om te wachten totdat men het er in Europa over eens is? Als je bedenkt dat met genetische manipulatie door gebruik te maken van een manier als CRISPR-CAS9, die we ook in de natuur vinden, maar oneindig veel sneller is, actief een bijdrage geleverd kan worden aan de voedselvoorziening.
Meer onderzoek en meer debat
De KNAW (Koninklijk Nederlandse Akademie van Wetenschappen) heeft in november 2016 een visiedocument uitgebracht over 'genome editing', met daarin ook allerlei vragen waarop antwoorden worden gezocht. Tot nog toe blijven veel vragen helaas onbeantwoord. En de urgentie om met antwoorden te komen lijkt te ontbreken. Er zijn vragen te over. Keuzes genoeg om te maken. Deze discussie moet nu, ook in 2020, en in de nabije toekomst in een breed maatschappelijk debat worden gevoerd. De uitkomsten kunnen en moeten wetenschappers noch regeringen bepalen, maar is aan de 'gewone' mensen. Wie kunnen hierover meepraten? Hoe kan het debat gevoerd worden? Welke mogelijkheden en onmogelijkheden zijn er? Kunnen de risico's worden ondervangen? Hoe moet dit worden gereguleerd? Wie ziet hierop toe? Door hierover samen te praten kunnen we de kansen van gentherapie, zoals CRISPR-CAS9, beheerst en verantwoord benutten.Het Rathenau Instituut heeft in een recent onderzoek (2020) benadrukt dat wetenschappelijke waarden en normen als onafhankelijkheid, georganiseerd scepticisme en belangeloosheid voorop zouden moeten staan als het gaat om gene editing bij gewassen. De genetisch gemodificeerde gewassen zouden dan ook niet alleen beoordeeld moeten worden op veiligheid, maar ook op maatschappelijk nut, duurzaamheid en ethische aspecten. In de studie wordt opnieuw het belang van het debat over gene editing aangegeven. Wetenschappers kunnen hierbij een speciale rol vervullen, namelijk die van kennismakelaars. Door de technieken, de mogelijkheden en de consequenties uit te leggen kunnen ze helpen bij het voeren van het debat en het maken van beleid hierop. Het is dan wel belangrijk dat er vertrouwen bestaat tussen publiek, wetenschap en politiek. Dat je praat én dat je luistert. Alleen door oprecht met elkaar in gesprek te gaan kom je verder.