Eiwitten in de voeding en in het lichaam
Iedereen weet dat je voldoende eiwitten moet eten. Vooral sporters weten dat. Maar wat is eigenlijk een eiwit? En wat doet een eiwit? En wat is een aminozuur? Waarom eten bodybuilders veel eiwiten?Wat is eigenlijk een eiwit?
Een eiwit bestaat uit aminozurenEen eiwit is een keten van aminozuren. Dat is de definitie. Maar wat is dan een aminozuur?
Een aminozuur is een molekuul, die een amino-groep en een zuur-groep heeft.
Wat een zuur-groep is, kun je lezen in het artikel Wat is eigenlijk een zuur?. In het kort: een zuur kan een proton (waterstof-ion, H+) afstaan.
Een andere karakteristieke groep van een aminozuur is de aminogroep. Een aminogroep wordt aangeduid als NH2. Aan het stikstof atoom N zitten twee waterstofatomen.
Een aminozuur heeft dus zowel een zuur als een amine; nomen est omen. Er zijn veel verschillende aminozuren, in de natuur komen er 20 voor die verschillen in grootte, vorm, lading en nog zo wat dingen. Wat ze allemaal hetzelfde hebben, is hun primaire skelet. Dat ziet er zo uit:
En dan onderaan het centrale koolstof zit een groep, die de verschillende aminozuren van elkaar onderscheidt. Het kan gewoon een waterstofatoom, H, zijn, dan heet het aminozuur glycine. Als het een methylgroep (CH3) is, noemen we het alanine. De andere structuren zijn:
Glycine, Alanine, Valine, Leucine, Isoleucine, Proline, Fenylalanine, Tyrosine, Tryptofan, Cysteine, Methionine, Serine, Threonine, Lysine, Arginine, Histidine, Aspartaat, Glutamaat, Asparagine en Glutamine. Zoals je ziet, eindigen veel namen op ~ine. Dat komt door de aminogroep. Glutamaat en Aspartaat hebben in de rest-groep een zuur-groep. Hierdoor hebben ze de uitgang ~aat gekregen. Een aantal aminozuren kunnen we zelf maken, maar er zijn er ook die we niet kunnen maken. Dat zijn de essentiële aminozuren; isoleucine, leucine, lysine, methionine, fenylalanine, threonine, tryptofaan en valine.
Linksdraaiende en rechtsdraaiende aminozuren
Een aminozuur is niet plat, zoals hij hier afgebeeld is. De hoeken tussen de zijgroepen zijn net iets meer dan 90ºC, dus de linker en de rechter zij-groep staan een beetje naar voren en de bovenste en onderste zij-groep staan een beetje naar achteren. Soms is het precies andersom, dan staan de linker en rechter groepen niet naar voren maar naar achteren en de onderste en bovenste naar voren. Het aminozuur is dan niet hetzelfde, er zijn twee verschillende! Je zou ze namelijk nooit precies over elkaar kunnen leggen. Sterker nog, ze zijn elkaars spiegelbeeld. We noemen het enantiomeren, dat betekent spiegelbeeld isomeren. Isomeren zijn stoffen die precies dezelfde atomen hebben, alleen anders in elkaar gepuzzeld. (Zie Wat is eigenlijk linksdraaiende yoghurt?). In dit geval zijn ze zo gepuzzeld dat ze in de spiegel wel hetzelfde lijken. De ene enantiomeer heet R, en de andere S. Afhankelijk van hoe ze gepolariseerd licht draaien, is de ene L en de andere D.
Aminozuren zijn aan elkaar gekoppeld tot eiwitten
Nu weten we wat aminozuren zijn, maar nog steeds niet precies wat een eiwit is. Een eiwit is een keten van aminozuren, zoals we aan het begin al lazen. De aminozuren zijn dus aan elkaar gekoppeld. Hoe?
Vaak geeft de zuurgroep een proton af aan de aminogroep van hetzelfde molecuul. Zo’n molekuul noemen we dan een Zwitter-ion, omdat het aan twee kanten een lading heeft. De zuurgroep is negatief geworden, want de positieve waterstof is vertrokken, en de aminogroep is positief geworden, juist doordat de waterstof daar gebonden is. Als twee van deze Zwitter-ionen elkaar dan tegenkomen, worden ze door elkaar aangetrokken. Positief en negatief trekt elkaar aan, en er kan zelfs een reaktie plaatsvinden. Twee van de waterstof-atomen van de amino-groep (die nu NH3+ is geworden!) en de zuurstof uit de zuurgroep (die nu –O- is) reageren met elkaar tot water terwijl de overblijvende N (stikstof) van de amino-groep koppelt met de koolstof (C) van de zuurgroep.
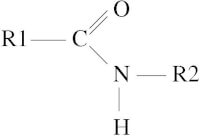 Bron: Rob Hooft, Wikimedia Commons (CC BY-SA-3.0)
Bron: Rob Hooft, Wikimedia Commons (CC BY-SA-3.0)Aminozuurvolgorde karakteriseert het eiwit
De aminozuren houden natuurlijk hun karakteristieke restgroep, onderaan de centrale koolstof. Zo kun je dus bijvoorbeeld een eiwit krijgen dat Lysine-Cysteine-Arginine heet, of afgekort Lys-Cys-Arg, en nog korter tot K-C-R.
Een heel belangrijk en bekend eiwit is insuline.
Sommige aminozuren zijn niet alleen gekoppeld met de naaste buren, maar ook met aminozuren een stukje verderop. Alleen cysteïne kan dat doordat de karakteristieke groep van cysteïne zwavel bevat. Zwavelatomen kunnen gemakkelijk aan elkaar binden. Er kunnen ook hele lange ketens gevormd worden. Insuline is niet eens zo heel groot. Hemoglobine bijvoorbeeld [BLOEDARMOEDE] is nog veel groter.
Primaire, secundaire, tertiaire structuur en stolling
De aminozuurvolgorde wordt de primaire structuur van een eiwit genoemd. Dan vouwt de keten zichzelf tot een structuur die we bijvoorbeeld een α-helix of β-sheet noemen. Door de bindingen tussen de cysteïnes ontstaat een driedimensionale structuur. Dat heet de tertiaire structuur. Als je eiwitten verhit, maak je die structuur plotseling kapot. Het eiwit denatureert (stolt) dan. Dat is wat er gebeurt als je een ei bakt of kookt of crème fraiche door je soep gooit; allemaal kleine stukjes gestold eiwit.
Functies van eiwitten
Eiwitten zijn eigenlijk de werkkrachten van het lichaam. Ze voeren allerlei processen uit, zoals het regelen van de bloedsuikerspiegel (insuline) maar ook zorgen ze voor het vervoer van ijzer (hemoglobine). De spieren bestaan voor het grootste deel uit de eiwitten actine en myosine. Deze eiwitten vormen een structuur die lijkt op twee kammen die in elkaar grijpen. Doordat de kammen in en uit elkaar grijpen, kunnen de spieren samentrekken en ook weer langer worden. Daardoor kunnen je spieren bewegingen uitvoeren. De functies van eiwitten zijn te veel om hier op te noemen.
Eiwit in de voeding
Als je onvoldoende eiwitten eet, zullen er talloze functies in het lichaam minder goed werken. Doordat je lichaam wel eiwitten nodig heeft, gaat het ze uit de spieren halen. Daardoor zal de spiermassa afnemen. Om dit te voorkomen eten bodybuilders massa's eiwitten. De wetenschappers zijn er nog niet uit hoe veel eiwit je zou moeten eten. Over het algemeen wordt aangehouden dat 0.8 g per kg lichaamsgewicht goed is, maar het is lastig om precies uit te rekenen hoeveel eiwitten je eet, omdat je dan bij alles wat je eet precies moet weten hoeveel eiwit er in zit en je dat dan moet omrekenen naar de porties die je eet. Bovendien speelt de aminozuursamenstelling ook een rol. Als je alleen grote hoeveelheden van een bepaald eiwit (bijvoorbeeld soja) eet, zou je bepaalde aminozuren in mindere mate binnen kunnen krijgen. De meest complete bronnen van aminozuren zijn vlees, eieren en melk. Dat lijkt ook logisch doordat vlees alle aminozuren zal hebben die een lichaam nodig heeft (wat immers ook vlees is). Eiwit uit ei is erop gericht om een kuiken uit het niets te laten ontstaan, dus zal ook alle eiwitten bevatten die een lichaam nodig heeft. En melk is erop gericht om een kind of kalf te laten groeien, en zal dus ook alle eiwitten bevatten die nodig zijn voor groei van het lichaam.