Nitrosaminen - vorming, consequenties en voorkomen
 Consumenten gebruiken steeds meer producten die, door middel van ingenieuze chemische processen, worden vervaardigd en verfijnd. Deze toevoeging van stoffen aan producten kan daarentegen ook nadelig uitpakken. Zo is het mogelijk dat producten carcinogene additieven bevatten, bijvoorbeeld dat de kassabon een laag bisfenol-A bevat, of dat er schadelijke stoffen worden gebruikt als verpakking en losweken in het voedsel. Nitrosaminen zijn een voorbeeld van een schadelijke stof, die ook in het lichaam kan worden gevormd, en zelfs carcinogeen is. Wat zijn nitrosaminen, hoe worden ze gevormd en hoe is het te vermijden?
Consumenten gebruiken steeds meer producten die, door middel van ingenieuze chemische processen, worden vervaardigd en verfijnd. Deze toevoeging van stoffen aan producten kan daarentegen ook nadelig uitpakken. Zo is het mogelijk dat producten carcinogene additieven bevatten, bijvoorbeeld dat de kassabon een laag bisfenol-A bevat, of dat er schadelijke stoffen worden gebruikt als verpakking en losweken in het voedsel. Nitrosaminen zijn een voorbeeld van een schadelijke stof, die ook in het lichaam kan worden gevormd, en zelfs carcinogeen is. Wat zijn nitrosaminen, hoe worden ze gevormd en hoe is het te vermijden?Nitrosaminen
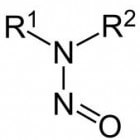
Nitrosaminen zijn niet per definitie een stof, maar eerder een functionele groep binnen de organische chemie. Dat wil zeggen dat zij een organisch molecuul een bepaalde eigenschap toekennen. Een voorbeeld is kaal ethaan en de stof ethanol: allebei hebben de moleculen twee koolstofatomen, maar ethaan is een gas op kamertemperatuur, terwijl ethanol (ook bekend als drinkbare alcohol) een vloeistof is op kamertemperatuur en oplosbaar is in water. Nitrosaminen bestaan uit een R-(R'-)N-N=O-binding, die is afgebeeld in figuur 1. In deze figuur worden R-groepen afgebeeld, die aangeven dat daar verschillende atomen kunnen binden, zoals een koolstofvertakking, een waterstofatoom etc.Vorming van nitrosaminen
De nitrosaminen kunnen worden gevormd zodra er een dermate grote hoeveelheid nitriet en eiwitten worden geconsumeerd. Nitriet-ionen (NO2-) en eiwitten kunnen binden onder zure, warme omstandigheden. In figuur 2 is de vorming van nitrosaminen afgebeeld. De moleculen die hierbij worden gebruikt bevinden zich vrijwel allemaal in de maag of de darmen. In combinatie met maagzuur (overweldigend vaak zoutzuur, HCl) hydreert het nitriet-ion zichzelf waardoor er waterstofnitriet (ook wel bekend als salpeterigzuur) wordt gevormd. Deze reactie verloopt aflopend in het lichaam, wat inhoudt dat de reactie niet in de omgekeerde volgorde wordt uitgevoerd. Dit is te herkennen aan de enkele pijl.
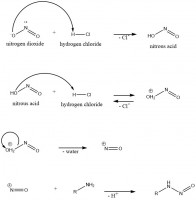 Figuur 2: vormingsmechanisme van nitrosaminen
Figuur 2: vormingsmechanisme van nitrosaminen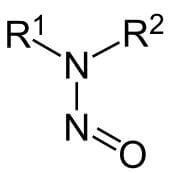 Figuur 1: De nitrosamine-groep /
Figuur 1: De nitrosamine-groep /