Neuskanker: symptomen, oorzaak en behandeling kanker in neus
 Neuskanker is een vorm van hoofd-halskanker. Bij neuskanker ontstaat kanker in de neusholte of de neusbijholten, respectievelijk neusholtekanker en neusbijholtekanker genoemd. Tumoren van de neus en neusbijholten komen in Nederland niet zo heel vaak voor. Langdurig roken is een risicofactor voor het ontwikkelen van deze kanker, alsmede een langdurig contact met tropische houtproducten. Vaak wordt bij neuskanker ingezet op radiotherapie (bestraling), gecombineerd met een operatieve ingreep. Als de kanker in een vroegtijdig stadium wordt ontdekt, is de prognose vrij gunstig. Uiteraard is dit ook afhankelijk van de plaats en de grootte van de tumor.
Neuskanker is een vorm van hoofd-halskanker. Bij neuskanker ontstaat kanker in de neusholte of de neusbijholten, respectievelijk neusholtekanker en neusbijholtekanker genoemd. Tumoren van de neus en neusbijholten komen in Nederland niet zo heel vaak voor. Langdurig roken is een risicofactor voor het ontwikkelen van deze kanker, alsmede een langdurig contact met tropische houtproducten. Vaak wordt bij neuskanker ingezet op radiotherapie (bestraling), gecombineerd met een operatieve ingreep. Als de kanker in een vroegtijdig stadium wordt ontdekt, is de prognose vrij gunstig. Uiteraard is dit ook afhankelijk van de plaats en de grootte van de tumor.- Neuskanker
- Over de neusholte en neusbijholten
- Neusholtekanker en neusbijholtekanker
- Wat is kanker?
- Hoofd-halskanker
- Typen kanker
- Epidemiologie
- Pathofysiologie en ontstaansmechanisme van neuskanker
- Oorzaken van neuskanker
- De invloed van levensstijl
- Beroepsmatige blootstelling en chemische stoffen
- Infecties en micro-organismen
- Omgevingsfactoren en luchtverontreiniging
- Genetische aanleg en erfelijkheid
- Chronische ontsteking en slijmvliesbeschadiging
- Risicofactoren van kanker in de neus
- Tabaksgebruik
- Alcohol
- Overige factoren
- Risicogroepen voor neuskanker: wie loopt het meeste gevaar?
- Beroepsgroepen met verhoogde blootstelling
- Rokers en mensen met een ongezonde leefstijl
- Personen met genetische aanleg
- Bewoners van industriële en stedelijke gebieden
- Mensen met chronische ontstekingen of infecties
- Ouderen en mannen
- Bewoners van specifieke regio’s wereldwijd
- Symptomen van neuskanker
- Verschijnselen
- Symptomen lijken op die van bijholteontsteking
- Onderzoek en diagnose
- Fysiek onderzoek en eerste signalen
- Endoscopie: het zichtbare maken van de neusholte
- Weefselonderzoek: de gouden standaard
- Beeldvormende technieken: het bepalen van de omvang
- Geavanceerde technieken: zeldzame en precieze diagnostiek
- Stadiëring en uitzaaiingen
- Rol van multidisciplinair overleg
- Stadium neuskanker
- Behandeling van neuskanker
- Soorten behandelingen
- Operatie
- Innovatieve chirurgische technieken
- Combinatiebehandelingen en multidisciplinaire aanpak
- Nazorg en revalidatie
- Praktische tips en zelfzorg bij neuskanker
- Zorg voor regelmatige medische controles
- Blijf goed gehydrateerd
- Beheer bijwerkingen van behandelingen
- Zorg voor je mondgezondheid
- Pas je dieet aan tijdens de behandeling
- Blijf actief binnen je mogelijkheden
- Versterk je mentale veerkracht
- Wees voorbereid op veranderingen in uiterlijk
- Zoek professionele ondersteuning indien nodig
- Bescherm je huid tegen zonlicht
- Bereid je voor op lange-termijnzorg en opvolging
- Gebruik innovatieve oplossingen voor herstel
- Prognose en overleving van neuskanker
- Complicaties van neuskanker
- Functionele complicaties
- Neurologische complicaties
- Aantasting van omliggende structuren
- Psychologische complicaties
- Langetermijncomplicaties
- Sociale en economische impact
- Preventie en voorkomen van neuskanker
Neuskanker
Elise, een energieke vrouw van 58, dacht dat haar aanhoudende verstopte neus en bloedneuzen te maken hadden met een hardnekkige bijholteontsteking. Toen haar klachten aanhielden, drong haar huisarts aan op verder onderzoek. De uitslag was onverwacht: een tumor in haar neusholte. Neuskanker is een zeldzame vorm van kanker die vaak pas laat wordt ontdekt, omdat de klachten in het begin op alledaagse problemen lijken. Elise ging de uitdaging aan met haar kenmerkende veerkracht en vastberadenheid, waarbij ze niet alleen haar eigen gezin inspireerde, maar ook anderen bewust maakte van het belang om klachten serieus te nemen.Neuskanker is een zeldzame vorm van kanker die ontstaat in de neusholte of bijholten. Vaak worden de eerste symptomen, zoals een verstopte neus, bloedneuzen of pijn in het gezicht, aangezien voor onschuldige problemen zoals een verkoudheid of bijholteontsteking. Juist door deze subtiele klachten wordt de diagnose vaak laat gesteld, wat een vroege behandeling bemoeilijkt. Het herkennen van aanhoudende of ongewone symptomen is essentieel om tijdig in te grijpen bij deze sluipende ziekte.
Deze vorm van kanker komt niet zo heel vaak voor. De frequentie wordt geschat op ruim 100 nieuwe gevallen per jaar. De incidentie bedroeg in 1998 0,8 op 100.000.¹ De aandoening komt bij mannen meer voor dan bij vrouwen. De frequentietop ligt om en nabij het 60e levensjaar.
 Neusbijholten / Bron: Own work, Wikimedia Commons (Publiek domein)
Neusbijholten / Bron: Own work, Wikimedia Commons (Publiek domein)Over de neusholte en neusbijholten
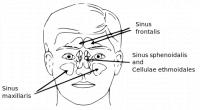
De neusholte is de ruimte net achter de neus waar de lucht naar de keel gaat. De neusbijholten zijn met lucht gevulde gebieden die de neusholte omringen. De volgende neusbijholten zijn er:- Voorhoofdsbijholten (frontale sinussen), gelegen boven de ogen;
- kaakbijholten (maxillaire sinussen), gelegen achter de wangen;
- Wiggebeenbijholten (sphenoïdale sinussen), ver achterboven in de neus;
- Voorste zeefbeenbijholten (anterieure ethmoïdale sinussen) en achterste zeefbeenbijholten (posterieure ethmoïdale sinussen), welke zich aan beide kanten tussen de neusholte en de oogkas bevinden.
Neusholtekanker en neusbijholtekanker
Wat is kanker?
Kanker is het ongeremd woekeren van afwijkende cellen, waardoor een massa genaamd een tumor wordt gevormd. Een tumor kan zowel kwaadaardig als goedaardig zijn. Kwaadaardige tumoren groeien meestal snel, de kankercellen kunnen doorgroeien in de omliggende weefsel en zich naar andere lichaamsdelen verspreiden (uitzaaien). Goedaardige tumoren daarentegen groeien normaal gesproken langzaam, rukken zich niet los uit hun oorspronkelijke omgeving en groeien er niet in door.Hoofd-halskanker
Neusholtekanker en neusbijholtekanker zijn twee van de belangrijkste soorten hoofd-halskanker. Hoewel neusbijholtekanker zich kan ontwikkelen in een van de sinussen, begint het gewoonlijk in de maxillaire sinus.Typen kanker
Er komen verschillende types kanker voor in de neus. De meest voorkomende vorm is het plaveiselcelcarcinoom, welke ontstaat in de oppervlakkige cellen die de binnenzijde van de neus(bij)holten bekleden. Een adenocarcinoom is een ander type. Deze ontstaat op de slijmklieren van de neus(bij)holten of neusbijholten.Epidemiologie
Neuskanker, ook bekend als sinonasale kanker, is een zeldzame vorm van kanker die voorkomt in de neusholte of bijholten. Wereldwijd varieert de incidentie aanzienlijk, beïnvloed door factoren zoals leeftijd, geslacht, klimaat, beroepsmatige blootstelling, en genetische aanleg. Hier volgt een uitgebreide analyse van de epidemiologie van deze zeldzame ziekte, met speciale aandacht voor Nederland, België en de overzeese gebiedsdelen.Leeftijds- en geslachtsverschillen
Neuskanker treft voornamelijk volwassenen, met een piekincidentie tussen de 50 en 70 jaar. Kinderen worden vrijwel nooit getroffen, met minder dan 1% van de gevallen geregistreerd in de pediatrische leeftijdsgroep. Mannen hebben een iets hogere kans om de ziekte te ontwikkelen, met een man-vrouwverhouding van ongeveer 3:2. Dit verschil wordt vaak toegeschreven aan een grotere mate van blootstelling aan risicofactoren zoals beroepsmatige stoffen en roken bij mannen.
Bijvoorbeeld, in Nederland worden jaarlijks ongeveer 80-100 nieuwe gevallen van neuskanker vastgesteld, waarbij mannen 60% van de patiënten uitmaken. In België zijn de cijfers vergelijkbaar, met een jaarlijkse incidentie van 2-3 gevallen per 1 miljoen inwoners.
Klimaatinvloeden en geografische verschillen
Klimaat en milieu spelen een rol in de epidemiologie van neuskanker. Hoge luchtvochtigheid en luchtverontreiniging worden geassocieerd met een verhoogd risico, vooral in stedelijke gebieden met veel industriële activiteit. In Nederland zien we een iets hogere incidentie in de Randstad, mogelijk door luchtverontreiniging en beroepsmatige blootstelling.
In de Nederlandse overzeese gebiedsdelen, zoals Curaçao en Aruba, is neuskanker extreem zeldzaam. Dit kan te maken hebben met een kleinere beroepsmatige blootstelling aan carcinogene stoffen in industrieën die in Europa meer voorkomen. Tegelijkertijd wordt een hogere blootstelling aan UV-straling in tropische gebieden, die gerelateerd is aan andere kankers, niet direct gelinkt aan neuskanker.
Vergelijking tussen Nederland, België en wereldwijd
In Nederland en België is neuskanker goed voor minder dan 1% van alle kankergevallen. De incidentie is vergelijkbaar in beide landen, maar België rapporteert iets hogere sterftecijfers, mogelijk door latere diagnoses. Wereldwijd zien we regionale verschillen. In Oost-Azië, zoals in Japan en Hongkong, is de incidentie tot wel vijf keer hoger, met ongeveer 1-2 gevallen per 100.000 inwoners per jaar, waarschijnlijk door een hogere prevalentie van blootstelling aan houtstof en chemische stoffen in traditionele beroepen.
In Afrika zijn gegevens beperkt, maar neuskanker lijkt hier minder vaak voor te komen, wat mogelijk te maken heeft met verschillen in levensstijl en beroepsmatige blootstellingen. In Zuid-Amerika, met name in Brazilië, is er een verhoogd risico onder arbeiders in de meubel- en houtverwerkingsindustrie.
Genetische factoren en erfelijkheid
Ofschoon genetica een secundaire rol speelt in het ontstaan van neuskanker, zijn er aanwijzingen dat een familiaire aanleg het risico erop kan verhogen. Mutaties in specifieke genen, zoals TP53 en KRAS, komen vaker voor bij patiënten met neuskanker. Bovendien kan een genetische gevoeligheid voor het ontwikkelen van kanker door blootstelling aan omgevingsfactoren een rol spelen.
Bijvoorbeeld, in een casus van een Nederlandse familie met meerdere leden werkzaam in de chemische industrie, ontwikkelden twee broers neuskanker binnen een periode van tien jaar, wat suggereert dat zowel genetische predispositie als gedeelde blootstelling een rol speelde.
Invloed van beroepsmatige blootstelling
Neuskanker wordt sterk geassocieerd met beroepsmatige blootstelling aan carcinogene stoffen. Risicoberoepen zijn onder andere meubelmaker, timmerman, leerbewerker en chemisch laborant. Werknemers in deze sectoren hebben een tot wel tien keer hoger risico. In België is dit risico historisch hoog geweest in de textiel- en chemische industrie van steden als Gent en Antwerpen.
Een concreet voorbeeld is een cohortstudie in de Nederlandse meubelindustrie, waarbij 25 gevallen van neuskanker werden vastgesteld onder 1.000 werknemers gedurende een periode van 30 jaar.
Invloed van levensstijl en preventie
Roken is een belangrijke risicofactor, met rokers die een tweemaal hoger risico hebben in vergelijking met niet-rokers. Overmatig alcoholgebruik wordt ook als mogelijke risicofactor genoemd. Preventieprogramma’s in Nederland en België richten zich op het verminderen van blootstelling aan carcinogenen op de werkplek en het bevorderen van een gezonde levensstijl.
Pathofysiologie en ontstaansmechanisme van neuskanker
Neuskanker, of sinonasale kanker, is een fascinerend maar tragisch voorbeeld van hoe normaal functionerende cellen in ons lichaam het spoor bijster raken. Het proces begint diep in de neusholte of de bijholten, waar het slijmvlies – normaal belast met bescherming en vochtregulatie – wordt blootgesteld aan schadelijke invloeden die leiden tot een kettingreactie van cellulaire ontregeling.Het begin: celbeschadiging en mutaties
De eerste stap in het ontstaan van neuskanker begint met blootstelling aan carcinogenen. Dit kunnen chemicaliën zijn zoals formaldehyde, houtstof, tabaksrook, of zelfs virale agentia zoals het humaan papillomavirus (HPV). Deze stoffen beschadigen het DNA van de epitheelcellen in het slijmvlies van de neusholte.
Deze beschadiging leidt tot mutaties in cruciale genen zoals TP53 (dat normaal gesproken beschadigd DNA repareert) en KRAS (dat de groei van cellen reguleert). Wanneer deze genen niet meer goed functioneren, verliezen cellen hun vermogen om normale groeipatronen te volgen. Dit resulteert in ongecontroleerde celdeling en de vorming van abnormale cellen die niet meer reageren op lichaamssignalen.
Ontregeling van de micro-omgeving
De tumor nestelt zich niet alleen in de neusholte, maar verandert ook de micro-omgeving waarin het zich ontwikkelt. Ontstekingsreacties in het slijmvlies worden chronisch, waarbij immuuncellen zoals macrofagen en neutrofielen in een constante staat van paraatheid verkeren. Deze ontsteking zorgt ervoor dat de omgeving rijk wordt aan groeifactoren, die de tumorcellen nog sneller laten groeien.
Een voorbeeld hiervan is de overproductie van vascular endothelial growth factor (VEGF), die nieuwe bloedvaten aanlegt om de tumor van voedingsstoffen te voorzien. Dit proces, angiogenese genoemd, is essentieel voor de tumorgroei en maakt de kanker agressiever en invasiever.
Invasie en metastasering
Neuskanker staat bekend om zijn neiging om zich snel uit te breiden naar omliggende structuren, zoals de schedelbasis, ogen en zelfs de hersenen. Dit komt doordat tumorcellen enzymen zoals matrixmetalloproteïnasen (MMP's) produceren, die omliggende weefsels afbreken. Hierdoor kunnen de cellen door barrières heen breken en nieuwe gebieden koloniseren.
Daarnaast kunnen tumorcellen via het lymfesysteem of bloedvaten metastaseren naar verre organen, zoals de longen of lever. Dit maakt de ziekte vaak in een laat stadium moeilijk te behandelen.
Het immuunsysteem en immuunontduiking
Een van de meest opmerkelijke eigenschappen van neuskanker is het vermogen om het immuunsysteem te misleiden. Tumorcellen ontwikkelen mechanismen om immuuncellen zoals T-lymfocyten te blokkeren of uit te schakelen. Bijvoorbeeld door de productie van PD-L1, een eiwit dat immuuncellen remt en voorkomt dat ze de tumor aanvallen.
Samenspel van risicofactoren en genetische aanleg
Hoewel blootstelling aan externe factoren zoals roken of houtstof vaak de drijvende kracht is achter het ontstaan van neuskanker, speelt genetische aanleg ook een belangrijke rol. Mutaties die van generatie op generatie worden doorgegeven, kunnen de gevoeligheid van cellen voor carcinogenen verhogen. Bij patiënten met een voorgeschiedenis van familieleden met hoofd-halskankers zien we vaker vroege en agressieve vormen van neuskanker.
Oorzaken van neuskanker
De precieze oorzaken van neuskanker, of tumoren in de neus- en bijholten, zijn complex en multifactorieel. Het ontstaat door een samenspel van genetische, omgevings- en levensstijlgerelateerde factoren. Hoewel sommige mechanismen nog niet volledig zijn ontrafeld, werpt wetenschappelijk onderzoek licht op de belangrijkste risicofactoren.De invloed van levensstijl
Leefstijl speelt een cruciale rol in het ontstaan van neuskanker, waarbij langdurig roken bovenaan de lijst van risicofactoren staat. Tabaksrook bevat meer dan 70 carcinogene stoffen, zoals benzeen en formaldehyde, die het DNA in de cellen van het neusslijmvlies beschadigen. Dit leidt tot mutaties in genen zoals TP53, een gen dat normaal gesproken DNA-schade herstelt. Zonder dit beschermingsmechanisme worden cellen kwetsbaar voor ongecontroleerde groei, wat de basis vormt voor tumorvorming.Bovendien hebben mensen die alcohol combineren met roken een aanzienlijk hoger risico, omdat alcohol de slijmvliezen gevoeliger maakt voor de schadelijke effecten van tabaksrook. Hoewel alcohol alleen geen directe oorzaak van neuskanker is, werkt het als katalysator in dit schadelijke proces.
Beroepsmatige blootstelling en chemische stoffen
Mensen die werken in beroepen met blootstelling aan specifieke chemische stoffen lopen een hoger risico. Blootstelling aan hardhoutzaagsel, nikkelstof, formaldehyde, en methanal wordt sterk geassocieerd met een verhoogde kans op neuskanker. Dit komt vooral voor in sectoren zoals de meubelmakerij, metaalbewerking, chemische productie en leerbewerking.Een onderzoek uit België toonde aan dat meubelmakers tot wel vijf keer meer kans hebben op het ontwikkelen van neuskanker door langdurige blootstelling aan hardhoutzaagsel. Deze deeltjes irriteren het neusslijmvlies en veroorzaken kleine, chronische ontstekingen. Na jaren van constante irritatie kan dit leiden tot DNA-schade en tumorvorming.
Formaldehyde, een chemische stof die wordt gebruikt in textiel en plastic, verhoogt het risico door directe schade aan de cellen van het slijmvlies. Inhalatie van deze stof gedurende meerdere jaren wordt specifiek gelinkt aan adenocarcinoom, een subtype van neuskanker dat vaak voorkomt bij mensen in deze beroepen.
Infecties en micro-organismen
Virale infecties, met name door het humaan papillomavirus (HPV), worden steeds vaker genoemd als risicofactor voor neuskanker. HPV produceert virale eiwitten die normale celgroei verstoren en de werking van tumoronderdrukkende genen, zoals RB1 en TP53, blokkeren. Dit maakt cellen vatbaar voor verdere genetische schade en ongecontroleerde groei.Daarnaast wordt blootstelling aan schimmels en andere micro-organismen in vochtige werkomgevingen, zoals kelders of zwembaden, in verband gebracht met neuskanker. Hoewel deze link minder direct is, kan langdurige ontsteking door chronische sinusitis, veroorzaakt door infecties, een risicofactor zijn.
Omgevingsfactoren en luchtverontreiniging
Luchtverontreiniging speelt een subtiele maar significante rol in het ontstaan van neuskanker. In stedelijke gebieden met hoge niveaus van fijnstof (PM2.5 en PM10) is een verhoogd aantal gevallen van neuskanker gemeld. Fijnstof bevat giftige stoffen zoals zware metalen en polycyclische aromatische koolwaterstoffen (PAK’s) die het neusslijmvlies irriteren en DNA-schade veroorzaken.Industriële emissies en blootstelling aan secundaire rook van fabrieken en verkeer zijn vooral schadelijk in dichtbevolkte gebieden. In regio's zoals de Randstad en Antwerpen is de incidentie iets hoger dan in landelijke gebieden, wat een weerspiegeling is van deze blootstelling.
In tropische gebieden, zoals de Nederlandse Cariben, lijkt neuskanker minder vaak voor te komen. Dit verschil kan worden toegeschreven aan minder blootstelling aan zware industrieën en een meer open leefomgeving.
Genetische aanleg en erfelijkheid
Hoewel omgevingsfactoren een dominante rol spelen, kan genetische aanleg het risico op neuskanker vergroten. Mutaties in specifieke genen, zoals BRCA1, TP53, en EGFR, verhogen de kwetsbaarheid van cellen voor carcinogene schade. Patiënten met een familiegeschiedenis van hoofd-halskanker lopen een verhoogd risico, wat wijst op een erfelijke component.Bijvoorbeeld, een studie in Nederland vond dat families met een geschiedenis van borstkanker en hoofd-halskanker vaker mutaties hadden in genen die betrokken zijn bij DNA-reparatie. Dit verklaart waarom sommige individuen sneller reageren op blootstelling aan carcinogene stoffen.
Chronische ontsteking en slijmvliesbeschadiging
Chronische ontsteking van het neusslijmvlies, zoals bij chronische sinusitis, kan een rol spelen bij het ontstaan van neuskanker. Aanhoudende ontstekingen verhogen de productie van reactieve zuurstofverbindingen (ROS), die DNA kunnen beschadigen. Deze schade wordt soms niet adequaat hersteld, wat kan leiden tot mutaties en tumorvorming.Langdurige irritatie, veroorzaakt door allergieën of blootstelling aan chemicaliën, creëert een omgeving waarin cellen constant in een staat van stress verkeren. Deze chronische stress maakt het neusslijmvlies kwetsbaar voor carcinogene processen.
Risicofactoren van kanker in de neus
Er zijn twee factoren die het risico op neuskanker aanzienlijk verhogen:- Tabaksgebruik; en
- Alcohol.
Tabaksgebruik
Tabaksgebruik is de grootste risicofactor voor hoofd-halskanker. Tabaksproducten bestaan uit sigaretten, sigaren, pijpen, kauwtabak en snuiftabak, een vorm van tabak die niet gerookt, maar gesnoven wordt. Zo'n 85% van hoofd-halskanker wordt geassocieerd met tabaksgebruik. Meeroken kan het risico op hoofd-halskanker ook vergroten. Roken is een belangrijke risicofactor voor het ontstaan van neuskanker / Bron: WerbeFabrik, Pixabay
Roken is een belangrijke risicofactor voor het ontstaan van neuskanker / Bron: WerbeFabrik, PixabayTabaksrook bevat meer dan 70 kankerverwekkende stoffen, waaronder polycyclische aromatische koolwaterstoffen (PAK’s), nitrosaminen en zware metalen zoals cadmium en nikkel. Wanneer tabaksrook via de neus wordt ingeademd, komen deze stoffen in direct contact met het neusslijmvlies. Het neusslijmvlies is kwetsbaar voor beschadiging door deze chemische stoffen, wat leidt tot celmutaties en verhoogd risico op kanker, zoals neuskanker (nasale en paranasale sinuscarcinomen).
Chronische irritatie van het neusslijmvlies
Tabaksrook veroorzaakt chronische irritatie en ontsteking van het neusslijmvlies. Deze constante irritatie leidt tot een verhoogde celdeling, omdat het lichaam probeert beschadigde cellen te vervangen. Hoe vaker cellen zich delen, hoe groter de kans op fouten in het DNA. Deze fouten kunnen resulteren in genetische mutaties die bijdragen aan het ontstaan van kanker. De ontstekingsreactie versterkt bovendien de productie van cytokines en groeifactoren die abnormale celgroei stimuleren.
Verstoord slijmvliesherstel
De kankerverwekkende stoffen in tabak beschadigen niet alleen het DNA, maar verstoren ook de natuurlijke reparatiemechanismen van cellen. Bovendien vermindert roken de bloedtoevoer naar de weefsels in de neus, wat leidt tot een slechtere toevoer van zuurstof en voedingsstoffen. Dit vertraagt de regeneratie van gezond weefsel en verhoogt het risico dat beschadigde cellen zich ongecontroleerd ontwikkelen tot kankercellen.
Specifieke invloed op het immuunsysteem
Tabaksgebruik onderdrukt het immuunsysteem, wat het vermogen van het lichaam vermindert om abnormale of gemuteerde cellen te herkennen en te vernietigen. Daarnaast stimuleert tabaksrook de productie van vrije radicalen, wat oxidatieve stress veroorzaakt. Dit verhoogt de kans op DNA-schade en bevordert het ontstaan van tumoren in de neusholte en de omliggende sinussen.
Voorbeeld: adenocarcinoom van de neusholte
Een veelvoorkomende vorm van neuskanker die sterk geassocieerd is met tabaksgebruik, is adenocarcinoom van de neusholte. Studies tonen aan dat rokers een significant verhoogd risico lopen op deze kanker in vergelijking met niet-rokers. Dit komt door de directe blootstelling van het slijmvlies aan de kankerverwekkende stoffen in tabaksrook, gecombineerd met de chronische ontstekingen en verminderde immunologische respons die roken veroorzaakt.
 Alcoholgebruik vergroot de kans op neuskanker / Bron: Marian Weyo/Shutterstock.com
Alcoholgebruik vergroot de kans op neuskanker / Bron: Marian Weyo/Shutterstock.comAlcohol
Frequente en zware consumptie van alcohol is een risicofactor voor hoofd-halskanker. Het gebruik van alcohol en tabak tezamen vergroot dit risico nog meer.Indirecte rol van alcohol bij neuskanker
Ofschoon alcohol minder direct wordt geassocieerd met neuskanker dan tabak, kan het toch een risicofactor zijn via indirecte mechanismen. Alcohol irriteert de slijmvliezen van de mond en keel, wat de kans op de verspreiding van schadelijke stoffen naar de neusholte vergroot. Mensen die zwaar drinken, hebben vaker ontstekingen of infecties in de bovenste luchtwegen, inclusief de neusholte, wat langdurige celschade kan veroorzaken en het risico op kanker vergroot.
Verhoogde doorlaatbaarheid van slijmvliezen
Alcohol beschadigt de epitheelcellen van de slijmvliezen, waardoor deze dunner en kwetsbaarder worden. Dit maakt het gemakkelijker voor kankerverwekkende stoffen uit andere bronnen, zoals tabak, luchtverontreiniging of industriële chemicaliën, om de cellen in de neusholte te penetreren en schade aan te richten. Bij mensen die zowel drinken als roken, versterkt alcohol het schadelijke effect van tabak in de neusholte.
Oxidatieve stress door alcohol
De afbraak van alcohol in het lichaam leidt tot de vorming van acetaldehyde, een kankerverwekkende stof. Hoewel de directe blootstelling van de neusholte aan acetaldehyde beperkt is, kan de systemische verspreiding via de bloedbaan bijdragen aan DNA-schade in de neusholte. Bovendien verhoogt alcoholgebruik de productie van reactieve zuurstofsoorten (ROS), die oxidatieve stress veroorzaken en een belangrijke rol spelen bij de ontwikkeling van kanker.
Onderdrukking van het immuunsysteem
Langdurig en overmatig alcoholgebruik onderdrukt het immuunsysteem, wat het lichaam minder effectief maakt in het herkennen en elimineren van gemuteerde cellen in de neusholte. Dit effect kan vooral schadelijk zijn in combinatie met andere risicofactoren, zoals blootstelling aan tabak of chemische stoffen op de werkplek, die bij kunnen dragen aan het ontstaan van neuskanker.
Voorbeeld: werkgerelateerde neuskanker
Bij mensen die beroepsmatig worden blootgesteld aan stof of chemische stoffen, zoals houtstof of formaldehyde, kan alcoholgebruik het risico op neuskanker verhogen. Bijvoorbeeld, een persoon die in een stoffige omgeving werkt en daarnaast zwaar drinkt, loopt een groter risico op adenocarcinoom in de neusholte. Alcohol vergroot de kwetsbaarheid van het neusslijmvlies, waardoor schadelijke stoffen uit de werkomgeving nog schadelijker worden.
 Neuspoliepen / Bron: Alila Medical Media/Shutterstock.com
Neuspoliepen / Bron: Alila Medical Media/Shutterstock.comOverige factoren
Andere factoren kunnen het risico van een persoon op het ontwikkelen van neuskanker vergroten:- Geslacht. Neusholtekanker en neusbijholtekanker komt tweemaal zo vaak voor bij mannen als bij vrouwen.
- Leeftijd. Neusholtekanker en neusbijholtekanker komen meestal voor bij mensen tussen de 45 en 85 jaar.
- Humane papillomavirus (HPV). Onderzoek toont aan dat infectie met HPV een risicofactor is voor neusholtekanker en neusbijholtekanker.
- Inademen van bepaalde stoffen. Het jarenlang blootstaan aan hardhoutzaagsel, nikkelstof, formaldehyde, methanal of oplosmiddeldampen die worden gebruikt bij de meubel- en schoenproductie.
- Blootstelling aan luchtvervuiling. Als je blootgesteld bent aan luchtvervuiling, kan het risico van een persoon op het ontstaan van neusholtekanker en neusbijholtekanker worden verhoogd.
- Cannabisgebruik. Onderzoek suggereert dat mensen die cannabis hebben gerookt misschien meer risico hebben op hoofd-halskanker.
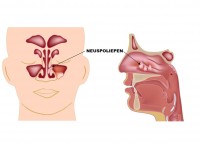
- Neuspoliepen. Neuspoliepen zijn meestal goedaardig, maar ontaarden mogelijk in neuskanker.
Risicogroepen voor neuskanker: wie loopt het meeste gevaar?
Neuskanker is een zeldzame ziekte, maar bepaalde groepen lopen een duidelijk verhoogd risico. Deze risicogroepen worden bepaald door een combinatie van omgevingsinvloeden, genetische aanleg en levensstijlkeuzes. Door deze groepen te identificeren, kunnen preventie en vroegtijdige opsporing gerichter worden ingezet.Beroepsgroepen met verhoogde blootstelling
Mensen die in bepaalde beroepen werken, hebben een veel hoger risico op neuskanker door langdurige blootstelling aan carcinogene stoffen. Deze groepen omvatten:- Meubelmakers en timmerlieden: Blootstelling aan hardhoutzaagsel is een van de sterkst bekende risicofactoren. Werken zonder adequate ventilatie en bescherming verhoogt het risico aanzienlijk.
- Metaalbewerkers: Blootstelling aan nikkelstof en chroomdeeltjes verhoogt de kans op mutaties in het slijmvlies.
- Chemische industrie: Werknemers die in aanraking komen met formaldehyde en andere giftige dampen, zoals in de productie van kunststoffen of textiel, lopen een verhoogd risico.
- Leerbewerkers en textielarbeiders: De aanwezigheid van fijnstof en chemicaliën in deze industrieën draagt bij aan een verhoogd risico op tumoren in de neusholte.
Bijvoorbeeld, een Belgische studie toonde aan dat meubelmakers tot vier tot vijf keer meer kans hebben om neuskanker te ontwikkelen dan de algemene bevolking.
Rokers en mensen met een ongezonde leefstijl
Langdurig roken verhoogt het risico op neuskanker aanzienlijk, doordat tabaksrook duizenden schadelijke chemicaliën bevat. Rokers lopen niet alleen risico door directe blootstelling, maar ook door de chronische ontstekingen die roken veroorzaakt in de slijmvliezen van de neusholte.- Gezamenlijke risicofactoren: Mensen die roken én in een risicoberoep werken, lopen een nóg groter risico.
- Alcoholgebruik: Ondanks dat alcohol geen directe oorzaak is, versterkt het de schadelijke effecten van roken en chemische blootstelling.
Personen met genetische aanleg
Genetische gevoeligheid speelt een belangrijke rol in het risico op neuskanker. Mutaties in genen zoals TP53 en BRCA1, die een sleutelrol spelen bij DNA-reparatie, vergroten de kwetsbaarheid van cellen voor beschadiging.- Familiegeschiedenis: Mensen met een familiegeschiedenis van hoofd-halskanker hebben een verhoogd risico op neuskanker, vooral als kanker op jonge leeftijd in de familie voorkomt.
- Erfelijke syndromen: Zeldzame genetische aandoeningen, zoals het Li-Fraumeni-syndroom, kunnen het risico verder verhogen.
Bewoners van industriële en stedelijke gebieden
In dichtbevolkte stedelijke gebieden, zoals de Randstad in Nederland en Antwerpen in België, lopen bewoners een verhoogd risico door blootstelling aan luchtvervuiling. Industriële emissies en fijnstof bevatten stoffen zoals polycyclische aromatische koolwaterstoffen (PAK’s), die bekend staan om hun carcinogene eigenschappen.- Stedelijke bewoners: Mensen die langdurig in stedelijke gebieden wonen met slechte luchtkwaliteit hebben een verhoogde kans op neuskanker.
- Industriële arbeiders: Werknemers in fabrieken zonder goede beschermingsmaatregelen vormen een belangrijke risicogroep.
Mensen met chronische ontstekingen of infecties
Chronische sinusitis of allergieën kunnen leiden tot een verhoogd risico op neuskanker. Langdurige ontstekingen veroorzaken oxidatieve stress, wat het DNA van cellen kan beschadigen.- Chronische sinusitis-patiënten: Langdurige irritatie van het slijmvlies maakt cellen vatbaarder voor mutaties.
- HPV-infectie: Infectie met het humaan papillomavirus (HPV), dat bekend staat om zijn rol bij baarmoederhalskanker, wordt ook in verband gebracht met bepaalde typen neuskanker.
Ouderen en mannen
Leeftijd en geslacht spelen ook een rol bij het risico op neuskanker. De meeste gevallen worden gediagnosticeerd bij mensen boven de 50 jaar, met een piekincidentie rond de 60-70 jaar.- Mannen: Neuskanker komt vaker voor bij mannen dan bij vrouwen, met een verhouding van ongeveer 3:2. Dit wordt vaak toegeschreven aan een hogere mate van blootstelling aan risicofactoren zoals roken en beroepsmatige stoffen.
- Vrouwen: Hoewel minder vaak getroffen, is er bij vrouwen soms sprake van blootstelling via passieve factoren, zoals luchtverontreiniging of roken door huisgenoten.
Bewoners van specifieke regio’s wereldwijd
De incidentie van neuskanker varieert sterk wereldwijd:- Europa: Lage incidentie (minder dan 1% van alle kankers), maar hoger in industriële regio’s zoals West-Duitsland, Nederland en België.
- Oost-Azië: In Japan en Hongkong wordt een verhoogd aantal gevallen gemeld, waarschijnlijk door hogere blootstelling aan chemische stoffen in traditionele beroepen.
- Zuid-Amerika: In landen zoals Brazilië is een verhoogd risico aangetoond bij arbeiders in de hout- en leerindustrie.
- Afrika: Hier lijkt neuskanker zeldzaam, hoewel data beperkt zijn.
Symptomen van neuskanker
Verschijnselen
De verschijnselen en klachten die kunnen optreden, zijn:- herhaaldelijke bloedneuzen die spontaan kunnen optreden;
- een verstopte neus of een loopneus (vrijkomen van pus), dikwijls aan één kant;
- korstjes in de neus;
- eenzijdige aangezichtspijn;
- terugkerende infectie en ontsteking van de bijholten;
- zwelling in het gezicht, hetgeen gepaard gaat met pijn;
- pijn boven of onder de ogen;
- post-nasale drip (slijm dat aan de achterkant van je neus je keel inloopt);
- gevoelloosheid van de tanden;
- constante waterige ogen;
- verlies van of veranderingen in het gezichtsvermogen;
- pijn of druk in één van de oren;
- problemen om de mond te openen;
- lymfeklieren in de nek die groter worden;
- verlies van reukvermogen, minder of niets meer kunnen ruiken.
Symptomen lijken op die van bijholteontsteking
Doordat de eerste symptomen die optreden hetzelfde zijn als bij sinusitis (bijholteontsteking - een ontsteking van het slijmvlies dat deze holten bedekt), verschijnt de patiënt vaak op het spreekuur van de huisarts wanneer hij een dikke wang, een hoogstand van het oog of een zwelling in de mond heeft.Onderzoek en diagnose
Het diagnosticeren van neuskanker is een zorgvuldig proces dat begint met het onderzoeken van symptomen en risicofactoren. Aangezien neuskanker zeldzaam is, worden uitgebreide en gespecialiseerde technieken ingezet om de ziekte nauwkeurig te identificeren en te stadieren. Het combineren van beeldvorming, endoscopie en geavanceerde diagnostische methoden is essentieel voor een correcte diagnose en behandelplan.Fysiek onderzoek en eerste signalen
De diagnose begint vaak met een uitgebreid gesprek en een lichamelijk onderzoek. Een KNO-arts onderzoekt de neusholte met behulp van een neusspeculum en een lamp om zichtbare afwijkingen, zoals zwellingen, bloedingen of afwijkende structuren, te detecteren. Verdachte symptomen zoals eenzijdige verstopping, bloedneuzen of pijn in het gezicht geven aanleiding tot verder onderzoek.Bij een eerste verdenking kan een endoscopie worden uitgevoerd.
Endoscopie: het zichtbare maken van de neusholte
Een endoscopie van de neus is een van de belangrijkste technieken om neuskanker op te sporen. Bij deze procedure wordt een flexibele of starre endoscoop, voorzien van een kleine camera en lichtbron, via de neus ingebracht. Dit geeft een gedetailleerd beeld van de neusholte en bijholten. De arts kan direct zien of er sprake is van een afwijking, zoals een tumor of zwelling.Indien een afwijking wordt gevonden, kan tijdens de endoscopie een biopt worden afgenomen. Dit weefselmonster is essentieel om de aard van de afwijking te bepalen.
Weefselonderzoek: de gouden standaard
Het weefsel dat via een biopsie is verkregen, wordt door een patholoog onderzocht onder de microscoop. Hier wordt gekeken naar celstructuren en eventuele kenmerken van kwaadaardigheid. Immunohistochemische kleuringen kunnen worden toegepast om specifieke markers van kanker, zoals p16 of EGFR, te identificeren.Bijvoorbeeld, bij een subtype als adenocarcinoom kan het pathologisch onderzoek aantonen dat de tumor afkomstig is van klierweefsel, terwijl plaveiselcelcarcinoom afwijkingen in het plaveiselepitheel laat zien. Deze informatie is cruciaal om het juiste behandeltraject te bepalen.
Beeldvormende technieken: het bepalen van de omvang
Om de grootte en locatie van de tumor te bepalen en om uitzaaiingen te detecteren, worden geavanceerde beeldvormingstechnieken ingezet.MRI-scan
Een MRI-scan (Magnetic Resonance Imaging) is bijzonder geschikt om zachte weefsels te visualiseren. Het biedt gedetailleerde beelden van de tumor, omliggende structuren en mogelijke ingroei in kritieke gebieden zoals de schedelbasis of oogkassen. MRI kan zelfs subtiele afwijkingen detecteren die niet zichtbaar zijn op een CT-scan.
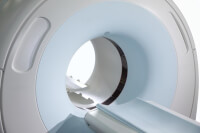 CT-scan / Bron: IStock.com/Pavel Losevsky
CT-scan / Bron: IStock.com/Pavel LosevskyEen CT-scan (Computed Tomography) wordt vaak gebruikt om botstructuren en de verspreiding van de tumor in de sinussen te beoordelen. Het is een snelle techniek die gedetailleerde doorsneden van de neusholte en omliggende gebieden levert. CT is vooral nuttig om botafbraak of botingroei door de tumor te evalueren.
PET-scan
Bij verdenking van uitzaaiingen wordt soms een PET-scan (Positron Emission Tomography) uitgevoerd. Hierbij wordt een radioactieve stof geïnjecteerd die zich ophoopt in actief delend weefsel, zoals tumorcellen. Dit helpt niet alleen om metastasen in bijvoorbeeld de longen of lymfeklieren op te sporen, maar geeft ook een indruk van de activiteit van de tumor.
Geavanceerde technieken: zeldzame en precieze diagnostiek
SPECT-scanEen SPECT-scan (Single Photon Emission Computed Tomography) is een minder gebruikelijke techniek die soms wordt ingezet om botmetastasen of subtiele afwijkingen in de schedelbasis te evalueren.
Navigatie-endoscopie
Bij moeilijk toegankelijke tumoren kan een navigatie-endoscopie worden gebruikt. Hierbij combineert men real-time beeldvorming met GPS-achtige technologie om uiterst nauwkeurig te opereren en biopten af te nemen.
Liquid biopsy (vloeibaar biopt)
In onderzoekscontext wordt steeds vaker een liquid biopsy toegepast, waarbij tumormateriaal wordt opgespoord in het bloed. DNA-fragmenten van de tumor kunnen genetische informatie geven over mutaties zoals KRAS of TP53, wat helpt bij het kiezen van doelgerichte therapieën.
Stadiëring en uitzaaiingen
Bij neuskanker is het essentieel om de tumor te stadieren, wat inhoudt dat de omvang, lokale ingroei en eventuele uitzaaiingen in kaart worden gebracht. Dit gebeurt met de TNM-classificatie:- T (Tumor): Grootte en lokale verspreiding van de tumor in de neusholte en bijholten.
- N (Nodes): Betrokkenheid van de lymfeklieren in de hals.
- M (Metastasen): Aanwezigheid van uitzaaiingen op afstand, bijvoorbeeld in de longen of lever.
Bijvoorbeeld, een T3-tumor wijst op lokale verspreiding naar omliggende structuren, terwijl M1 betekent dat er metastasen op afstand zijn.
Rol van multidisciplinair overleg
Bij de diagnose en behandeling van neuskanker is een multidisciplinair team van groot belang. Dit team bestaat uit KNO-artsen, radiologen, oncologen, pathologen en soms neurochirurgen. Samen beoordelen zij de onderzoeksresultaten en stellen een behandelplan op, afgestemd op de specifieke situatie van de patiënt.Stadium neuskanker
De uitgebreidheid van de kanker (wel of geen doorgroei en/of uitzaaiingen) wordt uitgedrukt in een stadium (I t/m IV). Het stadium kan aangeven welke behandeling nodig is en wat de overlevingskansen zijn.| Stadium | Omschrijving |
|---|---|
| Stadium 0 | Dit is een zeer vroege kanker, zonder verspreiding naar lymfeklieren of verre metastase (uitzaaiing). |
| Stadium I | Dit is een niet-invasieve kanker, zonder verspreiding naar lymfeklieren en geen verre metastase. De tumor zit alleen nog maar in de neus of neusbijholten. |
| Stadium II | Dit is een invasieve kanker die niet verspreid is naar lymfeklieren of naar verre delen van het lichaam. De tumor is doorgegroeid in het omringende weefsel. |
| Stadium III | Dit is een invasieve kanker zonder verspreiding naar regionale lymfeklieren en geen metastase. Of invasieve kanker die zich verspreid heeft naar regionale lymfeklieren, maar geen teken van metastase. |
| Stadium IVA | Dit is een invasieve kanker zonder metastasen of betrokkenheid van lymfeknopen, of is verspreid naar slechts één lymfeklier aan dezelfde kant. |
| Stadium IVB | Dit is een invasieve kanker die zich verspreid heeft naar lymfeklieren, maar geen metastase. |
| Stadium IVC | Dit verwijst naar elke tumor waarbij er sprake is van een verre verspreiding (metastase op afstand). |
Behandeling van neuskanker
De behandeling van neuskanker is een geavanceerd en multidisciplinair proces dat wordt afgestemd op de ernst van de aandoening, de locatie en de grootte van de tumor. Moderne medische technieken combineren chirurgie, radiotherapie, chemotherapie en innovatieve therapieën om zowel de tumor te bestrijden als de kwaliteit van leven te behouden. Het doel is niet alleen om de kanker te elimineren, maar ook om de structuur en functie van het aangetaste gebied zo goed mogelijk te herstellen.Soorten behandelingen
De keuze voor een behandeling hangt af van factoren zoals het stadium van de ziekte, de omvang van de tumor, en de algehele conditie van de patiënt.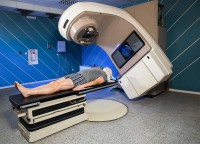 Radiotherapie (bestraling) bij neuskanker / Bron: Adriaticfoto/Shutterstock.com
Radiotherapie (bestraling) bij neuskanker / Bron: Adriaticfoto/Shutterstock.comRadiotherapie, of bestraling, is een veelgebruikte techniek bij neuskanker. Het kan als primaire behandeling worden ingezet, vooral bij kleinere tumoren, of na een operatie om eventuele resterende kankercellen te vernietigen. Moderne technieken zoals intensiteitsgemoduleerde radiotherapie (IMRT) maken het mogelijk om hoge doses straling nauwkeurig op de tumor te richten, terwijl omliggende gezonde weefsels worden gespaard.
Chemotherapie
Chemotherapie wordt vaak toegepast bij grotere tumoren, bij recidieven of wanneer uitzaaiingen aanwezig zijn. Het doel is om snel delende kankercellen in het hele lichaam te doden. In sommige gevallen wordt chemotherapie gecombineerd met radiotherapie (chemoradiatie) voor een krachtigere werking.
Doelgerichte therapie
Bij doelgerichte therapieën worden medicijnen gebruikt die specifiek inwerken op moleculen die betrokken zijn bij de groei en overleving van kankercellen.² Voorbeelden hiervan zijn EGFR-remmers, die het signaal voor ongecontroleerde celgroei blokkeren. Deze therapieën hebben vaak minder bijwerkingen dan traditionele chemotherapie.
Immunotherapie
Een innovatieve aanpak is immunotherapie, waarbij het immuunsysteem van de patiënt wordt gestimuleerd om kankercellen aan te vallen. Medicatie zoals PD-1/PD-L1-remmers blokkeert de mechanismen waarmee kankercellen het immuunsysteem ontwijken, waardoor het lichaam effectiever de tumor kan bestrijden.
Operatie
Chirurgie blijft een hoeksteen van de behandeling, vooral bij lokaal beperkte tumoren. Het doel is om de tumor volledig te verwijderen, samen met een marge van gezond weefsel om de kans op terugkeer te minimaliseren.Standaard chirurgische technieken
- Endoscopische chirurgie: Bij kleine tot middelgrote tumoren kan de tumor via een endoscoop worden verwijderd. Dit is minder invasief en resulteert vaak in een sneller herstel.
- Open chirurgie: Bij grotere tumoren of tumoren die zich hebben verspreid naar omliggende structuren, zoals de schedelbasis of oogkassen, is een open operatie noodzakelijk. Hierbij wordt een deel van het bot of omliggend weefsel verwijderd.
Reconstructieve chirurgie
Bij uitgebreide operaties kan reconstructieve chirurgie nodig zijn om de structuur en functie van het aangetaste gebied te herstellen.
- Flapreconstructie: Hierbij wordt weefsel van een ander deel van het lichaam, zoals de dij of onderarm, gebruikt om het verwijderde gebied te reconstrueren.
- Maxillofaciale protheses: Als het oog of een deel van de schedel wordt verwijderd, kunnen gespecialiseerde protheses worden ingezet om het uiterlijk te herstellen en functies zoals kauwen of spreken te verbeteren. Een maxillofaciaal-prosthodontist speelt hierbij een sleutelrol.
Innovatieve chirurgische technieken
Navigatie-geleide chirurgieMet behulp van 3D-beeldvorming en GPS-achtige technologie kunnen chirurgen uiterst precies opereren. Dit is vooral nuttig bij tumoren die dicht bij kritieke structuren, zoals de hersenen of bloedvaten, liggen.
Robotic-assisted surgery
Bij robotchirurgie gebruikt de chirurg een robotarm voor uiterst nauwkeurige bewegingen. Dit wordt vaak toegepast bij moeilijk toegankelijke tumoren en minimaliseert schade aan omliggend weefsel.
Cryochirurgie
In sommige gevallen kan cryochirurgie worden gebruikt, waarbij extreem lage temperaturen worden toegepast om tumoren te vernietigen. Dit wordt vooral gebruikt als aanvulling op andere behandelingen.
Combinatiebehandelingen en multidisciplinaire aanpak
Bij geavanceerde gevallen van neuskanker is vaak een combinatie van behandelingen nodig. Bijvoorbeeld:- Operatie gevolgd door radiotherapie: Om eventuele microscopische restanten van de tumor te vernietigen.
- Chemoradiatie: Een krachtige combinatie van chemotherapie en radiotherapie om de tumor te verkleinen of uitzaaiingen te bestrijden.
Een multidisciplinair team van specialisten, waaronder KNO-artsen, oncologen, radiotherapeuten en reconstructieve chirurgen, werkt nauw samen om een optimaal behandelplan op te stellen dat rekening houdt met zowel de medische als psychosociale behoeften van de patiënt.
Nazorg en revalidatie
Het herstelproces na behandeling is intensief en kan lange tijd duren. Patiënten kunnen te maken krijgen met fysieke uitdagingen, zoals problemen met ademhalen, spreken of slikken, en emotionele gevolgen van de behandeling. Revalidatie speelt daarom een belangrijke rol:- Fysiotherapie: Om functies zoals ademhalen en spraak te herstellen.
- Psychosociale ondersteuning: Om om te gaan met de emotionele impact van een ingrijpende behandeling.
- Logopedie: Bij problemen met spraak en slikken.
Praktische tips en zelfzorg bij neuskanker
Neuskanker: het klinkt als een verre, onwerkelijke bedreiging, maar voor wie ermee te maken krijgt, is het een heftige realiteit. Misschien herken je het zelf of ken je iemand die ermee worstelt. Wat je ook voelt, één ding staat vast: je wilt weten wat je kunt doen om ermee om te gaan. Het goede nieuws? Er zijn praktische stappen die je kunt nemen om de uitdagingen het hoofd te bieden. Niet alleen de bekende aanpakken, maar ook minder voor de hand liggende oplossingen kunnen een wereld van verschil maken.Het leven met neuskanker vraagt aanpassingen, zowel fysiek als mentaal. Behandelingen kunnen pittig zijn en je dagelijks leven flink opschudden. Daarom is het belangrijk om je voor te bereiden en te zorgen dat je lichaam én geest zo sterk mogelijk blijven. Van medische controles tot aandacht voor je voeding en huid, elke stap helpt om grip te houden op de situatie. Het gaat niet alleen om overleven, maar ook om de kwaliteit van je leven te waarborgen.
Naast de standaardadviezen zijn er ook innovatieve mogelijkheden die vaak minder bekend zijn. Denk bijvoorbeeld aan 3D-geprinte protheses die niet alleen esthetisch prachtig zijn, maar ook je functionaliteit verbeteren. Of het belang van mentale veerkracht—iets dat vaak wordt onderschat, maar essentieel is om de zware dagen door te komen. Deze aanpakken zijn geen luxe; ze kunnen je helpen je leven weer op de rails te krijgen.
Met deze tips bieden we een brede, praktische leidraad voor iedereen die met neuskanker te maken heeft. Het doel? Jou en je naasten handvatten geven om sterker uit deze zware periode te komen. Van hydratatie tot ondersteuning en alles daartussenin, deze stappen zijn er om je vooruit te helpen. Want hoe zwaar het ook wordt, je staat er niet alleen voor.
Zorg voor regelmatige medische controles
Het klinkt misschien vanzelfsprekend, maar het belang van regelmatige medische controles kan niet genoeg benadrukt worden. Neem Tim, een 54-jarige man, die dacht dat zijn neuskanker ‘onder controle’ was. Een routinecontrole bracht echter iets onverwachts aan het licht: een terugkerend plekje dat hij zelf niet had opgemerkt. Dankzij die tijdige ontdekking kon zijn arts snel ingrijpen. Je arts is als het ware je co-piloot in deze reis. Wacht niet tot de volgende grote scan—vraag ook tussendoor om bloedonderzoeken of kleinere checks, zoals een controle van ontstekingswaarden. Hoe eerder je erbij bent, hoe beter je de grip houdt.Blijf goed gehydrateerd
Water lijkt soms zo gewoon, maar het is echt een wondermiddel. Wist je dat uitdroging bij behandelingen zoals bestraling of chemo vaak voorkomt? Neem het verhaal van Sarah, een jonge moeder die tijdens haar behandelingen voortdurend last had van een droge mond. Haar arts raadde haar aan meer te drinken, maar ook slim te variëren, bijvoorbeeld met lichte, natuurlijke toevoegingen zoals citroen. Ze merkte niet alleen dat ze zich beter voelde, maar ook dat haar huid minder droog werd en ze meer energie had. Het hoeft geen liters per dag te zijn—gewoon zorgen dat je flesje altijd binnen handbereik is, doet al wonderen. Cranberrysap uit Israël / Bron: Nizzan Zvi Cohen, Wikimedia Commons (CC BY-SA-4.0)
Cranberrysap uit Israël / Bron: Nizzan Zvi Cohen, Wikimedia Commons (CC BY-SA-4.0)Beheer bijwerkingen van behandelingen
Iedere behandeling heeft z’n impact, dat is nu eenmaal zo. Van vermoeidheid tot misselijkheid—je lichaam wordt flink op de proef gesteld. Hier komt maatwerk om de hoek kijken. Denk aan voedingsmiddelen die je maag kalmeren, zoals cranberrysap of een boost aan vitamine C om je immuunsysteem een handje te helpen. Lisa, een 42-jarige vrouw, ontdekte dat een luchtbevochtiger haar enorm hielp tegen droge luchtwegen na radiotherapie. Zoek wat bij jou past—en vraag je arts of apotheker om tips op maat. Het zijn vaak de kleine aanpassingen die het verschil maken.Zorg voor je mondgezondheid
Dit is zo’n punt dat je misschien niet direct koppelt aan neuskanker, maar onderschat het niet. Behandelingen kunnen je mondflora behoorlijk ontregelen. Tim, ja diezelfde van hierboven, kreeg dit ook mee. Hij kreeg vaker last van bloedend tandvlees en kleine wondjes. Zijn tandarts gaf hem speciale mondspoelingen en zachte borstels die niet alleen zijn klachten verminderden, maar ook infecties voorkwamen. Het gaat om het vinden van een balans. Regelmatig poetsen, een goede mondspoeling, en letten op wat je eet (minder suiker!) maken een wereld van verschil. Soms is het zelfs slim om een diëtist of tandarts in te schakelen voor persoonlijk advies. Kurkuma / Bron: Ajale, Pixabay
Kurkuma / Bron: Ajale, PixabayPas je dieet aan tijdens de behandeling
Het klinkt misschien een beetje cliché, maar je bent écht wat je eet. Tijdens een behandeling voor neuskanker kan je spijsvertering veranderen en is je lichaam druk bezig met herstellen. Anna, een fanatieke hobbykok, ontdekte dat kleine aanpassingen in haar dieet grote verschillen maakten. Ze voegde bijvoorbeeld vaker peulvruchten toe aan haar maaltijden voor extra vezels en energie. En ze ging experimenteren met kurkuma, wat niet alleen kleur toevoegt, maar ook ontstekingsremmende eigenschappen heeft. Het draait niet om perfectie, maar om wat jouw lichaam goed verdraagt. Probeer zachte, voedzame maaltijden zoals soepen en smoothies, en vermijd pittige of zure gerechten als je slijmvliezen al gevoelig zijn.Blijf actief binnen je mogelijkheden
Beweging hoeft geen marathon te zijn—al is een blokje om soms al een overwinning. Voor Peter, een 62-jarige tuinier, was zijn conditie een bron van trots. Tijdens zijn behandeling schakelde hij over naar lichte oefeningen, zoals een korte wandeling door de wijk. Dit hielp niet alleen zijn spieren soepel te houden, maar gaf hem ook een mentale opkikker. Volgens studies kan regelmatige beweging zelfs je energie verbeteren en bijwerkingen verminderen. Luister naar je lichaam; een beetje rekken, een paar ademhalingsoefeningen of wat stretchen is al een stap in de goede richting. En vergeet niet: elk klein beetje helpt!Versterk je mentale veerkracht
Neuskanker tast niet alleen je lichaam aan, maar ook je geest. De onzekerheid, het wachten op uitslagen, de zware dagen—het kan je behoorlijk raken. Lisa, een creatieve duizendpoot, ontdekte dat schilderen haar hielp om emoties te verwerken. Maar mentale kracht zit ‘m ook in dagelijkse gewoonten. Zorg dat je regelmatig buitenkomt voor een frisse neus en vitamine D. Praat met iemand die je vertrouwt of schrijf je gedachten op. Het is oké om af en toe even in te storten, zolang je daarna weer probeert op te staan. Kleine rituelen, zoals een kopje thee of een favoriet boek, kunnen ook een bron van rust zijn.Wees voorbereid op veranderingen in uiterlijk
Behandelingen kunnen hun sporen nalaten, en dat kan even slikken zijn. Sophia, een modeontwerpster, vond het moeilijk om haar veranderde uiterlijk te accepteren. Maar ze besloot het stap voor stap aan te pakken. Ze experimenteerde met natuurlijke huidproducten, zoals arganolie, om haar huid te verzorgen. Ook vond ze nieuwe manieren om zich mooi te voelen, zoals met kleurrijke sjaals en hoeden. Het is belangrijk om tijd te nemen om aanpassingen te omarmen. Praat met je arts over reconstructieopties of cosmetische hulp, en vergeet niet dat echte schoonheid altijd van binnenuit straalt. Wat je ook kiest: wees mild voor jezelf en onthoud dat je krachtiger bent dan je denkt.Zoek professionele ondersteuning indien nodig
We denken vaak dat we alles zelf moeten oplossen, maar soms is hulp vragen juist een teken van kracht. Neem Mark, een 48-jarige man die worstelde met het emotionele gewicht van zijn neuskankerdiagnose. Hij klopte aan bij een oncologisch psycholoog en ontdekte dat praten over zijn angst en zorgen hem enorm opluchtte. Of je nu hulp zoekt bij een maatschappelijk werker, een diëtist, of een specialist in palliatieve zorg—er is altijd iemand die je kan begeleiden. Soms kan ook een simpele tip van een fysiotherapeut of voedingsdeskundige, zoals meer vitamine C om je immuunsysteem te ondersteunen, een wereld van verschil maken. Laat je niet tegenhouden door trots; je verdient het om goed geholpen te worden.Bescherm je huid tegen zonlicht
De zon is heerlijk, maar tijdens en na behandelingen kan je huid veel gevoeliger worden. Zo merkte Sofia, een enthousiaste wandelaar, dat zelfs een korte wandeling in de middagzon haar huid irriteerde. Ze begon trouw zonnebrandcrème te gebruiken, zelfs op bewolkte dagen, en ontdekte daarnaast de verzachtende kracht van natuurlijke oliën zoals arganolie. Het gaat niet alleen om esthetiek, maar ook om je huid gezond te houden en verdere schade te voorkomen. Kies een crème met een hoge SPF en draag een hoed of lichte sjaal wanneer je naar buiten gaat. Het zijn eenvoudige maatregelen die je huid een hoop ellende kunnen besparen.Bereid je voor op lange-termijnzorg en opvolging
Eenmaal de behandelingen afgerond, voelt het alsof je eindelijk kunt ademhalen. Maar het echte werk begint vaak pas daarna. Denk aan Anneke, die na haar behandelingen tegen neuskanker een strak opvolgingsplan kreeg. Regelmatige controles, bloedonderzoeken en het managen van kleine klachten werden een vast onderdeel van haar leven. Het kan overweldigend lijken, maar het biedt ook een gevoel van controle. Noteer belangrijke data, stel vragen aan je arts, en wees niet bang om zelf suggesties te doen. Zorg dat je een plan hebt voor elke stap, hoe klein ook. En onthoud: opvolging betekent niet dat het misgaat, maar juist dat je grip houdt.Gebruik innovatieve oplossingen voor herstel
De technologie staat niet stil, en dat is goed nieuws. Voor veel mensen met neuskanker bieden innovaties zoals 3D-geprinte protheses een combinatie van functionaliteit en esthetiek. Neem Thomas, die zijn zelfvertrouwen hervond dankzij een op maat gemaakte prothese. Hij merkte niet alleen dat hij zich beter voelde in sociale situaties, maar ook dat zijn ademhaling en comfort verbeterden. Vraag je behandelend arts naar de nieuwste opties, van reconstructieve chirurgie tot moderne hulpmiddelen. Het is geen luxe om deze mogelijkheden te overwegen—het gaat om jouw kwaliteit van leven. Durf groot te dromen, ook als het over je herstel gaat.Prognose en overleving van neuskanker
Neuskanker, een zeldzame maar complexe ziekte, kent een prognose die sterk afhankelijk is van het stadium waarin de diagnose wordt gesteld, de grootte en locatie van de tumor, en de algehele gezondheid van de patiënt. Hoewel de overlevingskansen in veel gevallen verbeterd zijn door geavanceerde diagnostische en behandelingsmethoden, blijft de prognose een uitdaging door de agressieve aard van de ziekte en de vaak late diagnose.Invloed van het stadium bij diagnose
De prognose bij neuskanker wordt grotendeels bepaald door het stadium waarin de ziekte wordt ontdekt. Hoe eerder de kanker wordt opgespoord, hoe groter de kans op genezing.
- Vroege stadia (stadium I en II): Bij tumoren die gelokaliseerd blijven in de neusholte of bijholten en niet zijn uitgezaaid, ligt de 5-jaarsoverleving rond de 70-80%. In dit stadium zijn chirurgische verwijdering en radiotherapie vaak succesvol.
- Gevorderde stadia (stadium III en IV): Wanneer de tumor zich uitbreidt naar omliggende structuren of er sprake is van uitzaaiingen naar lymfeklieren of organen, daalt de 5-jaarsoverleving naar 30-50%, afhankelijk van de exacte verspreiding en respons op behandeling.
Bijvoorbeeld, een patiënt met een kleine tumor in de maxillaire sinus heeft aanzienlijk betere vooruitzichten dan iemand met een tumor die zich heeft verspreid naar de schedelbasis of de oogkassen.
Type tumor en histologische kenmerken
De prognose varieert ook sterk op basis van het type neuskanker:
- Plaveiselcelcarcinoom: Dit is het meest voorkomende type en heeft een 5-jaarsoverleving van 30-60%, afhankelijk van de grootte en verspreiding.
- Adenocarcinoom: Heeft vaak een betere prognose, met overlevingspercentages van 50-70% bij vroegtijdige behandeling.
- Neuro-endocriene tumoren: Dit zeldzame subtype heeft een agressieve aard en een minder gunstige prognose, met een gemiddelde overleving van 20-30%.
- Melanoom: Melanomen van de neusholte zijn zeldzaam, maar hebben een slechte prognose met een 5-jaarsoverleving van minder dan 30%, vooral vanwege de neiging tot vroege uitzaaiingen.
Rol van behandelingen in de prognose
De effectiviteit van de behandeling speelt een sleutelrol in de overleving.
Chirurgie
Bij tumoren die volledig chirurgisch kunnen worden verwijderd, is de prognose aanzienlijk beter. Een 'schone' resectiemarge, waarbij geen tumorcellen worden achtergelaten, verhoogt de kans op langdurige overleving.
Radiotherapie
Radiotherapie kan de overlevingskansen verbeteren, vooral wanneer het wordt gecombineerd met chirurgie. Bij kleine tumoren of tumoren die niet operabel zijn, kan radiotherapie alleen een 5-jaarsoverleving van 40-60% bieden.
Chemotherapie en doelgerichte therapieën
Chemotherapie wordt vaak gebruikt bij gevorderde stadia of recidieven, maar verbetert zelden de overleving significant. Doelgerichte therapieën en immunotherapie bieden hoop, vooral bij tumoren met specifieke genetische kenmerken, zoals overexpressie van EGFR of PD-L1.
Factoren die de overleving beïnvloeden
Naast het stadium en de behandeling zijn er andere factoren die de prognose beïnvloeden:
- Leeftijd en algemene gezondheid: Jonge en gezonde patiënten hebben doorgaans betere vooruitzichten vanwege een grotere tolerantie voor intensieve behandelingen.
- Uitzaaiingen: Wanneer de kanker zich heeft verspreid naar vitale organen zoals de longen of lever, wordt de prognose aanzienlijk slechter. De gemiddelde overleving in deze gevallen is vaak minder dan 1-2 jaar.
- Responstijd: Patiënten die snel reageren op therapie hebben een betere kans op langdurige overleving.
Late diagnose en impact op prognose
Een groot probleem bij neuskanker is dat het vaak pas in een laat stadium wordt ontdekt. Symptomen zoals een verstopte neus of bloedneuzen worden vaak genegeerd of toegeschreven aan minder ernstige aandoeningen. Bij patiënten waarbij de tumor zich al heeft verspreid naar de hersenen of schedelbasis, daalt de overleving dramatisch, met een 5-jaarsoverleving van minder dan 30%.
Recidief en secundaire tumoren
Zelfs na succesvolle behandeling blijft het risico op een terugkeer (recidief) of de ontwikkeling van een secundaire tumor hoog. Recidieven komen voor bij ongeveer 30-50% van de patiënten, vaak binnen de eerste twee jaar na behandeling. Het risico op secundaire tumoren, zoals longkanker, is verhoogd bij patiënten die blijven roken of langdurig zijn blootgesteld aan carcinogenen.
Langetermijnperspectieven en kwaliteit van leven
Zelfs bij succesvolle behandeling kan de kwaliteit van leven worden beïnvloed door blijvende gevolgen van de ziekte of behandeling, zoals:
- Moeite met ademhalen door nasale obstructies.
- Functionele beperkingen, bijvoorbeeld bij kauwen of spreken.
- Psychosociale gevolgen, zoals angst voor terugkeer van de ziekte of veranderde lichaamsbeleving.
Een goede nazorg en multidisciplinaire ondersteuning zijn uitermate belangrijk om deze uitdagingen te overwinnen en de levenskwaliteit van patiënten te waarborgen.
Toekomstperspectieven: hoop door innovatie
Dankzij voortdurende vooruitgang in diagnostiek en behandeling verbeteren de overlevingskansen voor neuskanker. Innovatieve therapieën zoals immunotherapie, precisiegeneeskunde en robotchirurgie beloven niet alleen betere resultaten, maar ook minder bijwerkingen en een hogere levenskwaliteit. Onderzoek naar genetische en moleculaire kenmerken van neuskanker kan leiden tot gepersonaliseerde behandelingen die de prognose verder verbeteren.
Met deze vooruitzichten blijft de hoop groeien dat zelfs bij een late diagnose de overlevingskansen en kwaliteit van leven kunnen worden verbeterd bij mensen met neuskanker.
Complicaties van neuskanker
Neuskanker is niet alleen een uitdagende ziekte door de behandeling en diagnose, maar ook door de complicaties die ermee gepaard kunnen gaan. Deze complicaties variëren van fysiek en functioneel verlies tot emotionele en sociale gevolgen. Veel van deze complicaties ontstaan door de agressieve aard van de ziekte, de locatie in een anatomisch complex gebied en de intensieve behandelingen die nodig zijn. Hieronder volgt een overzicht van de meest voorkomende complicaties, met voorbeelden en cijfers.Functionele complicaties
AdemhalingsproblemenBij neuskanker kan de tumor de luchtwegen blokkeren, wat leidt tot ademhalingsmoeilijkheden. Na chirurgie kan littekenweefsel of anatomische veranderingen dit probleem verergeren. Ongeveer 30% van de patiënten ervaart langdurige ademhalingsproblemen na een uitgebreide operatie of bestraling.
Bij uitgebreide tumoren, of wanneer de behandeling omliggende structuren aantast, kunnen slikken en spreken ernstig worden belemmerd. Bestraling kan leiden tot droge slijmvliezen, wat slikken nog moeilijker maakt. Tot 20-25% van de patiënten ervaart langdurige slikproblemen.
Neurologische complicaties
ZenuwbeschadigingTumoren die zich uitbreiden naar de schedelbasis of oogkassen kunnen zenuwen beschadigen, wat leidt tot gevoelloosheid, verlamming of pijn. Na chirurgie of bestraling kan dit probleem blijven bestaan. Bij patiënten met gevorderde tumoren ontwikkelt ongeveer 15-20% symptomen zoals eenzijdige gezichtspijn of gezichtsverlamming.
Wanneer de tumor zich uitbreidt naar de oogkassen of wanneer bestraling oogstructuren beschadigt, kan gezichtsvermogen aangetast worden. In ernstige gevallen kan een oog verwijderd worden. Bij patiënten met tumoren die de oogkassen betrekken, treedt visusverlies op bij ongeveer 10-15% van de gevallen.
Aantasting van omliggende structuren
Botafbraak en infectiesBij tumoren die de kaak of schedelbasis aantasten, kan botafbraak optreden. Na chirurgie kan een verhoogd risico op infecties in de sinussen of omliggende weefsels ontstaan. Tot 20% van de patiënten ervaart terugkerende sinusinfecties door littekenvorming of anatomische veranderingen.
Bij uitgebreide chirurgie kan een fistel ontstaan, bijvoorbeeld tussen de neusholte en mondholte. Dit kan leiden tot voedsel- en vloeistoflekkage naar de neusholte, wat slikken en eten bemoeilijkt. Fistels komen voor bij ongeveer 5-10% van de uitgebreide reconstructieve operaties.
Psychologische complicaties
Depressie en angstDe ingrijpende aard van de ziekte, gecombineerd met de functionele en cosmetische veranderingen, kan leiden tot psychologische stress. Ongeveer 40% van de patiënten rapporteert symptomen van angst of depressie, vooral na grote operaties of bij recidieven.
Cosmetische veranderingen, zoals littekens of het verlies van gezichtsdelen, kunnen een grote impact hebben op het zelfbeeld. Reconstructieve chirurgie of protheses kunnen helpen, maar nemen de emotionele last niet altijd volledig weg.
Langetermijncomplicaties
RecidievenZelfs na succesvolle behandeling keert neuskanker in 30-50% van de gevallen binnen vijf jaar terug. Dit risico is hoger bij gevorderde stadia en bij tumoren die niet volledig chirurgisch verwijderd konden worden.
Patiënten die radiotherapie of chemotherapie ondergaan, lopen een verhoogd risico op het ontwikkelen van secundaire kankers, zoals longkanker of leukemie. Dit risico wordt geschat op 5-10% na intensieve behandelingen.
Sociale en economische impact
Naast medische complicaties ervaren veel patiënten ook sociale en economische gevolgen. Langdurige behandelingen en revalidatie kunnen leiden tot werkverlies en financiële problemen, terwijl beperkingen in ademhaling, spraak en uiterlijk sociale interacties bemoeilijken.Preventie en voorkomen van neuskanker
Hoewel er geen bewezen manier is om neus(bij)holtekankerr volledig te voorkomen, kan je het risico verminderen. Het belangrijkste wat je kan doen is het stoppen met het gebruik van alle tabaksproducten, dit geldt ook voor mensen die al jarenlang tabak hebben gebruikt. Het voorkomen van blootstelling aan stoffen die erom bekend staan dat zij het risico op kanker vergroten, kan dit risico nog verder verminderen. Werknemers die met stoffen werken die de gezondheid kunnen schaden, dienen een beschermend gezichtsmasker te dragen om te voorkomen dat er potentieel schadelijke stoffen worden ingeademd. Werkgevers moeten passende maatregelen nemen waarmee de gevaren voor de gezondheid en de veiligheid van de werknemers kunnen worden voorkomen.Noten:
[OLIST]C.J.H. van de Velde (redactie): Oncologie; zevende herziene druk, Bohn Stafleu van Loghum, 2005, p. 214.
Doelgerichte kankertherapie staat ook bekend als 'targeted therapy', 'gerichte therapie', 'moleculaire therapie', 'doelgerichte moleculaire therapie', of 'moleculaire doelgerichte behandeling'.[/OLIST]