Lymfeklierkanker: symptomen, oorzaken en behandeling
 Lymfeklierkanker symptomen zijn onder meer onverklaarbaar gewichtsverlies, nachtzweten, onbegrepen koorts of moeheid en een lymfekliervergroting, bijvoorbeeld een knobbel onder je oksel of in de hals. Lymfeklierkanker ontstaat vaak in de cellen in de lymfeklieren. Een ander woord voor lymfeklierkanker is lymfoom. Er zijn twee hoofdtypen: Hodgkinlymfoom en non-Hodgkinlymfoom (NHL). Beide typen komen voor in alle leeftijdsgroepen, vooral bij ouderen. Hodgkin komt evenwel relatief vaak voor bij adolescenten van begin 20. Behandeling bestaat vaak uit chemotherapie en radiotherapie. De levensverwachting varieert en is onder meer afhankelijk van het type lymfoom. Er zijn anno 2025 geen manieren bekend om lymfeklierkanker te voorkomen.
Lymfeklierkanker symptomen zijn onder meer onverklaarbaar gewichtsverlies, nachtzweten, onbegrepen koorts of moeheid en een lymfekliervergroting, bijvoorbeeld een knobbel onder je oksel of in de hals. Lymfeklierkanker ontstaat vaak in de cellen in de lymfeklieren. Een ander woord voor lymfeklierkanker is lymfoom. Er zijn twee hoofdtypen: Hodgkinlymfoom en non-Hodgkinlymfoom (NHL). Beide typen komen voor in alle leeftijdsgroepen, vooral bij ouderen. Hodgkin komt evenwel relatief vaak voor bij adolescenten van begin 20. Behandeling bestaat vaak uit chemotherapie en radiotherapie. De levensverwachting varieert en is onder meer afhankelijk van het type lymfoom. Er zijn anno 2025 geen manieren bekend om lymfeklierkanker te voorkomen.
- Wat is lymfeklierkanker?
- Twee hoofdtypen
- NHL komt het meeste voor
- Laaggradige en hooggradige NHL
- Epidemiologie
- Twee typen lymfomen
- Lymfeklierkanker oorzaken
- Oorzaak is vaak onbekend
- Risicofactoren voor lymfeklierkanker
- Combinatie van factoren
- Lymfeklierkanker symptomen
- Stadiëring van lymfeklierkanker: een nauwkeurig beeld van de ziekte-uitbreiding
- Stadium I: een lokaal begin
- Stadium II: beperkte, regionale verspreiding
- Stadium III: verspreiding over beide zijden van het diafragma
- Stadium IV: uitgebreide, systemische verspreiding
- De rol van aanvullende kenmerken: A en B-symptomen
- Onderzoek en diagnose
- Anamnese en lichamelijk onderzoek
- Lymfeklierbiopsie
- Bloedonderzoek
- Beenmergaspiratie
- Röntgenfoto van de borst
- MRI
- PET-scan
- CT-scan
- Moleculaire testen
- Lymfeklierkanker behandeling
- Chemotherapie
- Bestralingstherapie
- Immunotherapie
- Stamceltransplantatie
- Gerichte therapieën
- Steroidtherapie
- Externe en experimentele behandelingen
- Afstemmen van de behandeling
- Prognose en levensverwachting
- Complicaties
- Preventie
Wat is lymfeklierkanker?
Toen Sophie, een energieke jonge vrouw van 28, merkte dat een knobbeltje in haar hals maar niet verdween, dacht ze aanvankelijk dat het een onschuldige zwelling was door een verkoudheid. Maar weken later, toen ook vermoeidheid en nachtelijk zweten aanhielden, ging ze toch naar de huisarts. Een paar onderzoeken verder kreeg ze de onverwachte diagnose: Hodgkinlymfoom. De angst sloeg toe, maar de arts stelde haar gerust dat Hodgkinlymfoom vaak goed te behandelen is. Sophie’s vastberadenheid om de kanker te verslaan begon vanaf dat moment, en met steun van haar familie begon ze aan een intensieve, maar veelbelovende behandeling.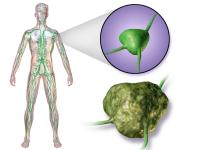 Lymfeklierkanker en het lymfevatenstelsel / Bron: Blausen Medical Communications, Inc., Wikimedia Commons (CC BY-3.0)
Lymfeklierkanker en het lymfevatenstelsel / Bron: Blausen Medical Communications, Inc., Wikimedia Commons (CC BY-3.0)Twee hoofdtypen
Lymfeklierkanker (lymfoom) is een vorm van kanker die ontstaat in de lymfocyten – een type witte bloedcel dat essentieel is voor het immuunsysteem. Deze lymfocyten bevinden zich in de lymfeklieren, milt, thymus of zwezerik, het beenmerg en andere delen van het lymfestelsel. Lymfeklierkanker kan in elk van deze structuren ontstaan en zich verspreiden naar andere delen van het lichaam. Er worden twee hoofdtypen lymfeklierkanker onderscheiden:- Hodgkinlymfoom (HL), met vijf verschillende subtypen. Dit type wordt gekenmerkt door de aanwezigheid van Reed-Sternberg-cellen, grote afwijkende cellen die bij microscopisch onderzoek zichtbaar zijn en specifiek zijn voor Hodgkinlymfoom.
- Non-Hodgkinlymfoom (NHL), dat in meer dan 30 verschillende vormen voorkomt en zich op verschillende manieren kan gedragen, afhankelijk van de exacte subtype.
NHL komt het meeste voor
Non-Hodgkinlymfoom is de meest voorkomende vorm van lymfeklierkanker en maakt ongeveer 85% van de gevallen uit. Hodgkinlymfoom komt bij ongeveer 15% van de mensen met lymfoom voor en komt vaker voor bij jongvolwassenen en mensen tussen de 15 en 40 jaar.Laaggradige en hooggradige NHL
Non-Hodgkinlymfoom is een overkoepelende term voor een diverse groep lymfeklierkankers, waarbij meer dan 30 subtypen worden onderscheiden. Er wordt vaak onderscheid gemaakt tussen laaggradige (indolente) en hooggradige (agressieve) NHL, wat invloed heeft op de behandeling en prognose.- Laaggradige NHL ontwikkelt zich langzaam, met milde symptomen die geleidelijk erger worden. Patiënten met dit type lymfoom reageren vaak goed op een milde behandeling, zoals chemotherapie, immunotherapie of een combinatie daarvan. Het nadeel is echter dat de kanker na enkele jaren kan terugkeren.
- Hooggradige NHL is een agressiever type dat snel groeit en zich snel kan verspreiden naar andere organen. Patiënten met hooggradige NHL hebben doorgaans intensievere therapieën nodig, zoals intensieve chemotherapie en soms beenmergtransplantaties. Deze behandelingen zijn gericht op het snel aanpakken van de kankercellen en het voorkomen van verdere verspreiding.
Epidemiologie
Lymfeklierkanker, ook wel lymfoom genoemd, omvat twee hoofdtypen: Hodgkinlymfoom (HL) en non-Hodgkinlymfoom (NHL). Hoewel het wereldwijd voorkomt, zijn de verspreiding, risicofactoren, en leeftijds- en geslachtsverschillen niet overal hetzelfde. Klimaat, voeding, leefstijl en genetische aanleg spelen allemaal een rol in de ontwikkeling van lymfomen, en zelfs tussen landen zoals Nederland, België en hun overzeese gebieden zijn er subtiele, maar betekenisvolle verschillen. Hier volgt een uitgebreid overzicht van de epidemiologische gegevens over lymfeklierkanker, aangevuld met relevante cijfers en voorbeelden.Geslachts- en leeftijdsverschillen
De incidentie van lymfeklierkanker verschilt duidelijk tussen mannen en vrouwen, en ook de leeftijd is een bepalende factor. Hodgkinlymfoom (HL) komt vaker voor bij jongvolwassenen tussen de 15 en 40 jaar, en mannen hebben een iets hogere kans dan vrouwen. Bij non-Hodgkinlymfoom (NHL), de meest voorkomende vorm van lymfoom, neemt de incidentie sterk toe met de leeftijd, vooral na de leeftijd van 55 jaar.
- Cijfer HL: Hodgkinlymfoom komt voor bij ongeveer 2 op de 100.000 mensen wereldwijd, met een lichte mannelijke dominantie.
- Cijfer NHL: Non-Hodgkinlymfoom is veel vaker voorkomend en treft jaarlijks ongeveer 20 per 100.000 mensen. Ook hier hebben mannen een verhoogd risico, en de incidentie neemt toe met de leeftijd.
Voorbeeld: In Nederland worden jaarlijks ruim 4.000 nieuwe gevallen van non-Hodgkinlymfoom gediagnosticeerd, terwijl Hodgkinlymfoom zich vooral bij jongvolwassenen aandient, met ongeveer 400 nieuwe gevallen per jaar.
Geografische en klimatologische verschillen
Lymfeklierkanker komt wereldwijd voor, maar de incidentie verschilt per regio. In Westerse landen zoals Nederland en België is de incidentie hoger dan in ontwikkelingslanden. Dit verschil wordt vaak toegeschreven aan omgevingsfactoren en levensstijl, maar ook genetische aanleg kan een rol spelen.
- Nederland en België: Hier komt lymfeklierkanker gemiddeld vaker voor dan in minder geïndustrialiseerde landen. Vooral NHL heeft een relatief hoge incidentie in beide landen, waarschijnlijk door een combinatie van genetische aanleg, voeding, en een zittende leefstijl.
- Nederlandse overzeese gebieden: In de Caribische regio, zoals op Aruba en Curaçao, wordt lymfeklierkanker minder vaak gediagnosticeerd. Dit kan worden verklaard door genetische verschillen en leefstijl, zoals een dieet met meer verse groenten en vis.
- Wereldwijde trends: De hoogste incidentie van NHL wordt gezien in Noord-Amerika en Europa, terwijl Aziatische en Afrikaanse landen lagere aantallen melden. Dit kan te maken hebben met genetische factoren en blootstelling aan bepaalde virussen, zoals het Epstein-Barr-virus, dat in sommige Afrikaanse en Aziatische populaties meer voorkomt en geassocieerd wordt met specifieke vormen van lymfoom.
Voorbeeld: In België is de incidentie van non-Hodgkinlymfoom één van de hoogste in Europa, met meer dan 2.000 nieuwe gevallen per jaar, terwijl in sommige delen van Afrika deze vorm van lymfeklierkanker slechts incidenteel voorkomt.
Genetische factoren en familiegeschiedenis
Genetische aanleg speelt een rol in het risico op lymfeklierkanker. Mensen met een familiegeschiedenis van lymfoom of andere vormen van kanker hebben vaak een verhoogd risico. Specifieke genetische mutaties kunnen de kans op het ontwikkelen van lymfeklierkanker vergroten. Verder komen genetische syndromen zoals het Lynch-syndroom of ataxia-telangiectasia vaker voor bij mensen met een verhoogd risico op lymfomen.
Cijfer: Bij mensen met een eerstegraads familielid met Hodgkinlymfoom is de kans op het ontwikkelen van HL ongeveer 3-5 keer hoger dan bij mensen zonder familiegeschiedenis.
Voorbeeld: Onderzoek in Nederland naar genetische verbanden heeft aangetoond dat bij mensen met een familielid met lymfoom de incidentie van zowel Hodgkin- als non-Hodgkinlymfoom hoger ligt, wat genetische screenings nuttig maakt voor risicogroepen.
Leefstijl: voeding, roken en zittende levensstijl
Leefstijl kan een rol spelen in het ontstaan van lymfeklierkanker, met name bij non-Hodgkinlymfoom. Een dieet dat rijk is aan bewerkt vlees, verzadigde vetten en suikers wordt in verband gebracht met een verhoogd risico, terwijl een plantaardig dieet en regelmatige lichaamsbeweging een beschermende werking kunnen hebben. Roken wordt gezien als een risicofactor, vooral bij NHL, en mensen met een zittende levensstijl hebben vaak een hogere incidentie van lymfeklierkanker.
 Groenten verlagen het risico op lymfeklierkanker / Bron: Istock.com/warrengoldswain
Groenten verlagen het risico op lymfeklierkanker / Bron: Istock.com/warrengoldswain- Roken: Ofschoon roken minder vaak in verband wordt gebracht met lymfoom dan met andere kankersoorten, tonen sommige studies aan dat het een licht verhoogd risico geeft op NHL.
- Dieet: Studies suggereren dat het eten van veel bewerkt vlees en suiker de kans op lymfeklierkanker kan verhogen, terwijl groenten, fruit, en vezels het risico verlagen.
Voorbeeld: In Nederland wordt non-Hodgkinlymfoom vaker gezien bij mensen met een zittend beroep, wat de relatie met een inactieve leefstijl ondersteunt. Ook worden in België verbanden gevonden tussen de consumptie van bewerkt vlees en verhoogde lymfeklierrisico’s.
Omgevingsfactoren en blootstelling aan virussen
Bepaalde omgevingsfactoren en blootstelling aan virussen zijn geassocieerd met een verhoogd risico op lymfeklierkanker. Het Epstein-Barr-virus (EBV), dat mononucleosis (de ziekte van Pfeiffer) veroorzaakt, kan bijvoorbeeld bijdragen aan Hodgkinlymfoom, vooral bij jongere mensen. Verder wordt blootstelling aan chemicaliën, zoals pesticiden en oplosmiddelen, in verband gebracht met een hoger risico op NHL.
- Epstein-Barr-virus: Dit virus wordt vooral in verband gebracht met Hodgkinlymfoom, en in ontwikkelingslanden met Burkitt-lymfoom, een subtype van NHL dat vaak voorkomt bij kinderen.
- Pesticiden: Langdurige blootstelling aan pesticiden, zoals in landbouwgebieden, kan het risico op lymfomen verhogen. Studies tonen aan dat boeren en landarbeiders vaker non-Hodgkinlymfoom ontwikkelen.
Cijfer: Bij mensen met een voorgeschiedenis van het Epstein-Barr-virus is het risico op Hodgkinlymfoom ongeveer 2 tot 3 keer zo hoog als bij mensen zonder blootstelling.
Twee typen lymfomen
Lymfeklierkanker, oftewel lymfoom, kent twee belangrijke typen: Hodgkinlymfoom (HL) en non-Hodgkinlymfoom (NHL). Hoewel ze zich vaak in dezelfde gebieden van het lichaam ontwikkelen – zoals in de hals, oksels, of lies – en vergelijkbare symptomen geven, zijn hun kenmerken en gedrag wezenlijk verschillend. Het meest opvallende en doorslaggevende onderscheid wordt gemaakt door een microscopisch onderzoek van een stukje weefsel, een biopt, waarin specifieke celtypen zichtbaar worden die bij elk type anders zijn.Bij zowel HL als NHL wordt de groei van lymfocyten, een type witte bloedcel, oncontroleerbaar. Toch groeien deze cellen op verschillende manieren en geven zij elk hun eigen klinische beeld en therapierespons.
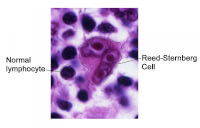 Reed-Sternberg cellen / Bron: National Cancer Institute, Wikimedia Commons (Publiek domein)
Reed-Sternberg cellen / Bron: National Cancer Institute, Wikimedia Commons (Publiek domein)Hodgkinlymfoom wordt gekenmerkt door de aanwezigheid van een zeer specifieke, afwijkende cel: de Reed-Sternberg-cel. Deze grote, meestal tweekernige cel, is een “handtekening” van Hodgkinlymfoom. Onder de microscoop lijkt deze cel een bijna "uilachtig" beeld te vormen door de opvallende kernen en grote vorm. De aanwezigheid van Reed-Sternberg-cellen is de doorslaggevende factor in de diagnose van Hodgkinlymfoom en maakt het onderscheid met NHL.
In de kern van HL treedt abnormale celgroei op van lymfocyten, die zich via de lymfeklieren verspreiden. Het kan leiden tot gezwollen en pijnloze lymfeklieren, vaak samen met symptomen zoals koorts, nachtelijk zweten en onverklaard gewichtsverlies.
Non-Hodgkinlymfoom: veelzijdige types en een ongeremde deling
Non-Hodgkinlymfoom is een verzamelnaam voor een grote diversiteit aan lymfomen, waarbij meer dan 30 verschillende subtypen worden onderscheiden. Deze subtypen kunnen enorm variëren in gedrag, presentatie en gevoeligheid voor behandelingen. Het grootste verschil met HL is dat bij NHL geen Reed-Sternberg-cellen aanwezig zijn. In plaats daarvan groeien de lymfocyten ongecontroleerd en blijven zich vermenigvuldigen, wat leidt tot vergroting van de lymfeklieren en soms verspreiding naar andere organen zoals de milt, lever en het beenmerg.
De verscheidenheid van NHL maakt dit type lymfoom veel complexer in diagnostiek en behandeling. NHL-lymfomen kunnen langzaam of zeer agressief groeien, en de symptomen variëren afhankelijk van het subtype en de snelheid van tumorgroei. De indolente (laaggradige) vormen van NHL ontwikkelen zich langzaam en kunnen jarenlang stabiel blijven, terwijl agressieve (hooggradige) vormen snel groeien en onmiddellijke behandeling vereisen.
Het onderscheid: een wereld van verschil onder de microscoop
Onder de microscoop laten HL en NHL hun unieke kenmerken zien, wat artsen helpt om de juiste diagnose te stellen en een passende behandeling te starten. De aanwezigheid van Reed-Sternberg-cellen bevestigt een diagnose van Hodgkinlymfoom, terwijl afwezigheid van deze cellen, samen met het patroon van ongeremde celdeling, leidt tot een NHL-diagnose.
Hodgkinlymfoom is vaak goed behandelbaar en reageert doorgaans positief op chemotherapie en radiotherapie. Non-Hodgkinlymfoom daarentegen varieert sterk: indolente subtypes kunnen milde behandelingen vereisen en terugkeren over een langere tijd, terwijl agressieve vormen intensieve therapieën vragen.
Het onderscheid tussen HL en NHL is niet alleen cruciaal voor de diagnose, maar ook voor de behandelkeuze en prognose.
 Overgewicht is een risicofactor voor lymfeklierkanker / Bron: Istock.com/VladimirFLoyd
Overgewicht is een risicofactor voor lymfeklierkanker / Bron: Istock.com/VladimirFLoydLymfeklierkanker oorzaken
Oorzaak is vaak onbekend
Bij grofweg 90 tot 95 procent van de gevallen van lymfeklierkanker blijft de oorzaak onbekend. Ofschoon het mechanisme waarmee lymfeklierkanker ontstaat nog niet volledig begrepen is, wijzen wetenschappelijke inzichten op verschillende factoren die het risico op lymfeklierkanker verhogen. Hieronder staan de belangrijkste risicofactoren opgesomd die mogelijk bijdragen aan het ontstaan van lymfomen. Naast leeftijd en genetische aanleg spelen virussen, leefstijl, en chemische blootstelling ook een grote rol in het risico op lymfeklierkanker.Risicofactoren voor lymfeklierkanker
Leeftijd van 60 jaar of ouder: Naarmate men ouder wordt, neemt het risico op lymfeklierkanker toe. Oudere leeftijd gaat vaak gepaard met een verzwakt immuunsysteem, wat het lichaam minder weerbaar maakt tegen veranderingen in de lymfocyten.- Geslacht: Mannen hebben een iets grotere kans op lymfeklierkanker dan vrouwen, mogelijk door genetische en hormonale verschillen die het immuunsysteem beïnvloeden.
- Overgewicht: Studies tonen aan dat mensen met overgewicht of obesitas een hoger risico hebben op lymfeklierkanker. De precieze oorzaak is onduidelijk, maar een verstoorde stofwisseling en chronische ontsteking door vetophopingen in het lichaam zouden hieraan kunnen bijdragen.
- Een zwak immuunsysteem door hiv/aids, een orgaantransplantatie of een aangeboren immuunziekte: Een verzwakt immuunsysteem kan het lichaam kwetsbaar maken voor ongecontroleerde groei van lymfocyten, de cellen waarin lymfoom zich ontwikkelt.
- Auto-immuunziekten zoals reumatoïde artritis, het syndroom van Sjögren, lupus of coeliakie: Bij deze aandoeningen valt het immuunsysteem de eigen cellen aan, wat de kans op abnormale celgroei vergroot en het risico op lymfomen kan verhogen.
- Infecties met bepaalde virussen, zoals het Epstein-Barr-virus, hepatitis C, en humaan herpesvirus 8 (HHV-8): Deze virussen verstoren het normale functioneren van het immuunsysteem en kunnen genetische veranderingen in lymfocyten veroorzaken, wat de kans op lymfeklierkanker verhoogt.
- Genetische aanleg: Het hebben van een naast familielid met lymfoom verhoogt het risico op lymfeklierkanker. Bepaalde genetische mutaties kunnen worden doorgegeven, waardoor de kans op abnormale celgroei groter wordt.
- Blootstelling aan chemische stoffen zoals benzeen of pesticiden voor ongediertebestrijding en onkruidverdelgers: Langdurige blootstelling aan chemische stoffen kan schadelijke veranderingen in het immuunsysteem en de lymfocyten veroorzaken, wat op termijn kan leiden tot lymfeklierkanker.
- Eerdere diagnose van Hodgkinlymfoom of non-Hodgkinlymfoom: Mensen die eerder behandeld zijn voor Hodgkinlymfoom of non-Hodgkinlymfoom hebben een verhoogde kans dat lymfeklierkanker terugkeert of dat zich een ander subtype ontwikkelt.
- Bestraling in het verleden: Het ondergaan van bestraling als behandeling voor andere kankersoorten kan het risico op lymfeklierkanker verhogen, omdat de straling kan leiden tot genetische veranderingen in lymfocyten.
Combinatie van factoren
Vaak is het een combinatie van bovenstaande factoren die het risico verhoogt. Iemand met een zwak immuunsysteem én blootstelling aan een virus kan bijvoorbeeld een groter risico lopen. Hoewel veel van deze factoren het risico vergroten, hoeft niet iedereen met een van deze factoren lymfeklierkanker te ontwikkelen.- Voorbeeld: Iemand van 65 jaar die in de landbouw werkt en regelmatig met pesticiden in aanraking komt, heeft door de blootstelling aan chemische stoffen én zijn leeftijd een hoger risico op lymfeklierkanker. Als deze persoon ook een zwak immuunsysteem heeft of besmet is geweest met het Epstein-Barr-virus, verhoogt dit de kans nog verder.
Samengevat ontstaat lymfeklierkanker meestal zonder duidelijke oorzaak, maar bepaalde leefstijlen, infecties, genetische factoren en blootstelling aan schadelijke stoffen kunnen het risico vergroten.
Lymfeklierkanker symptomen
Symptomen van lymfeklierkanker zijn vaak subtiel en worden gemakkelijk verward met andere, minder ernstige aandoeningen. Toch kunnen sommige klachten wijzen op lymfeklierkanker, vooral als ze langdurig aanhouden of zonder duidelijke oorzaak ontstaan. Hieronder staan de meest voorkomende symptomen op een rij: Buikpijn door vergrite lymfeklieren in de buik / Bron: Istock.com/Wavebreakmedia
Buikpijn door vergrite lymfeklieren in de buik / Bron: Istock.com/Wavebreakmedia- Opgezwollen lymfeklieren: Pijnloze zwellingen in de lymfeklieren, vaak in de nek, oksel of lies, kunnen een van de eerste tekenen van lymfeklierkanker zijn. Dit komt doordat de abnormale lymfocyten zich ophopen en de lymfeklieren vergroten.
- Hoest en Kortademigheid: Wanneer lymfeklierkanker zich in de borstholte bevindt, kunnen gezwollen lymfeklieren op de luchtwegen drukken, wat kan leiden tot een aanhoudende hoest en moeite met ademhalen.
- Koorts en Nachtzweten: Onverklaarde koorts en nachtelijk zweten kunnen wijzen op het lichaam dat probeert een infectie of abnormale celgroei te bestrijden. Deze symptomen komen vooral voor bij agressievere vormen van lymfeklierkanker.
- Buikpijn: Vergrote lymfeklieren in de buik kunnen druk veroorzaken en pijn opwekken. In sommige gevallen kan dit ook leiden tot een opgeblazen gevoel of verstopping.
- Vermoeidheid: Chronische vermoeidheid, zonder duidelijke reden, kan een van de subtiele symptomen zijn van lymfeklierkanker. Dit ontstaat doordat het lichaam veel energie verbruikt om de abnormale cellen te bestrijden.
- Onverklaarbaar gewichtsverlies: Gewichtsverlies zonder dieet of verhoogde lichaamsbeweging kan een teken zijn dat het lichaam hard werkt om de ziekte te bestrijden. Onverklaard gewichtsverlies van meer dan 10% van het lichaamsgewicht in een paar maanden kan wijzen op lymfeklierkanker of een andere ernstige aandoening.
- Jeuk: Hoewel het een minder bekend symptoom is, kan intense jeuk, vooral zonder uitslag, voorkomen bij sommige mensen met lymfeklierkanker. Dit wordt soms veroorzaakt door cytokinen – stoffen die door het immuunsysteem worden geproduceerd als reactie op de kanker.
Veel van deze symptomen kunnen ook wijzen op andere aandoeningen, zoals infecties of auto-immuunziekten. Het is daarom belangrijk om bij aanhoudende of onverklaarde klachten contact op te nemen met een arts. Een vroege diagnose kan de prognose van lymfeklierkanker aanzienlijk verbeteren, vooral bij snelgroeiende vormen.
Stadiëring van lymfeklierkanker: een nauwkeurig beeld van de ziekte-uitbreiding
Bij de diagnose van lymfeklierkanker is stadiëring cruciaal om een volledig beeld te krijgen van de mate waarin de ziekte zich in het lichaam heeft verspreid. De stadia van lymfeklierkanker worden internationaal erkend in vier hoofdgroepen, van stadium I (vroegtijdige, beperkte ziekte) tot stadium IV (geavanceerde verspreiding). De stadiëring bepaalt niet alleen de ernst van de ziekte, maar ook welke behandelingen het meest effectief zijn en de prognose voor de patiënt.Hier volgt een gedetailleerd overzicht van de stadia van lymfeklierkanker, waarbij wordt uitgelegd wat elk stadium inhoudt en hoe dit wordt vastgesteld.
Stadium I: een lokaal begin
In stadium I is de ziekte beperkt tot één enkele lymfeklierregio of een enkel orgaan dat tot het lymfestelsel behoort. Deze vroege fase geeft hoop, omdat de kanker zich nog niet heeft verspreid buiten de oorspronkelijke locatie, en de behandeling meestal gericht kan worden op een klein, goed afgebakend gebied.- Stadium I nodulair: Betreft één groep van lymfeklieren, bijvoorbeeld in de nek of oksel.
- Stadium I extranodulair: Betreft één enkel orgaan buiten de lymfeklieren, zoals de milt of thymus.
Voorbeeld: Een patiënt met Hodgkinlymfoom en een enkele aangetaste lymfeklier in de hals bevindt zich in stadium I. Bij deze beperkte verspreiding kan gerichte bestraling vaak al voldoende zijn om de ziekte onder controle te krijgen.
Stadium II: beperkte, regionale verspreiding
In stadium II heeft de kanker zich uitgebreid naar twee of meer groepen lymfeklieren aan dezelfde kant van het diafragma (de scheiding tussen borst- en buikholte). De ziekte blijft boven of onder het diafragma en heeft nog niet beide lichaamshelften aangetast.- Stadium II nodulair: De kanker bevindt zich in meerdere lymfekliergroepen, maar alleen boven of onder het diafragma.
- Stadium II extranodulair: Naast de aangetaste lymfeklieren bevindt de kanker zich in een nabijgelegen orgaan.
Voorbeeld: Een patiënt met non-Hodgkinlymfoom heeft aangetaste lymfeklieren in de oksel en nabijgelegen lymfeklieren in de borst, allemaal boven het diafragma. Dit wordt ingedeeld als stadium II, en behandelingen zoals chemotherapie en/of bestraling kunnen worden ingezet om de groei onder controle te houden.
Stadium III: verspreiding over beide zijden van het diafragma
In stadium III heeft lymfeklierkanker zich uitgebreid naar lymfeklieren boven én onder het diafragma, wat betekent dat de ziekte zich op beide lichaamshelften bevindt. Dit stadium vertegenwoordigt een meer geavanceerde ziekte, en de kanker kan ook beginnen zich naar nabijgelegen organen en weefsels uit te breiden.- Stadium III nodulair: De ziekte verspreidt zich naar lymfeklieren zowel boven als onder het diafragma, zoals in de nek en het bekken.
- Stadium III extranodulair: Naast verspreiding in de lymfeklieren kan de kanker zich ook uitbreiden naar een aangrenzend orgaan of weefsel.
Voorbeeld: Bij een patiënt met non-Hodgkinlymfoom in zowel de nek als het bekken is sprake van stadium III. In dit stadium zijn intensievere behandelingen zoals chemotherapie in combinatie met bestraling of immunotherapie vaak vereist om de ziekte onder controle te krijgen.
Stadium IV: uitgebreide, systemische verspreiding
Stadium IV is het meest geavanceerde stadium van lymfeklierkanker. De ziekte is wijdverspreid in het lichaam en heeft zich buiten de lymfeklieren verspreid naar organen zoals de lever, longen, botten of beenmerg. Bij stadium IV is de kanker systemisch geworden, wat betekent dat de kankercellen door het hele lichaam aanwezig zijn.- Stadium IV met extranodulaire betrokkenheid: De kanker heeft belangrijke organen bereikt buiten het lymfestelsel, zoals de lever of longen, en kan zich ook in het beenmerg bevinden.
- Systemische behandeling: Vanwege de uitgebreide aard van de ziekte is een systemische behandeling nodig, zoals intensieve chemotherapie, immunotherapie en mogelijk stamceltransplantatie.
Voorbeeld: Een patiënt met Hodgkinlymfoom waarbij kanker is vastgesteld in de lymfeklieren en ook in de lever en het beenmerg wordt geclassificeerd als stadium IV. Bij deze uitgebreide verspreiding zijn vaak agressieve behandelingen nodig om de kanker zo goed mogelijk terug te dringen.
De rol van aanvullende kenmerken: A en B-symptomen
Elk stadium wordt verder gespecificeerd door de aanwezigheid van zogeheten A- en B-symptomen, die kunnen wijzen op de activiteit en agressiviteit van de ziekte:- A-symptomen: Geen bijkomende symptomen zoals koorts, nachtelijk zweten of gewichtsverlies.
- B-symptomen: Koorts, nachtzweten en/of onverklaard gewichtsverlies. De aanwezigheid van B-symptomen kan duiden op een agressievere vorm van de ziekte en kan invloed hebben op de behandelingsstrategie.
Voorbeeld: Een patiënt in stadium III met gewichtsverlies en nachtelijk zweten zou worden geclassificeerd als stadium III-B, wat betekent dat een meer intensieve behandeling noodzakelijk kan zijn.
Betekenis van stadiëring voor de behandeling
Stadiëring helpt niet alleen bij het bepalen van de omvang van de ziekte, maar vormt ook de basis voor de behandelingskeuze. Bij vroege stadia (I en II) kunnen gerichte behandelingen zoals bestraling en milde chemotherapie voldoende zijn. In gevorderde stadia (III en IV) wordt vaak gekozen voor systemische behandelingen, waaronder uitgebreide chemotherapie, immunotherapie en, indien nodig, stamceltransplantatie.
De stadiëring biedt artsen en patiënten een helder inzicht in de mate van verspreiding en helpt bij het opstellen van een behandelplan dat specifiek is afgestemd op de situatie van de patiënt. Van gerichte bestraling in een vroeg stadium tot uitgebreide immuuntherapie en chemotherapie in een later stadium: de juiste stadiëring geeft richting aan een behandelingspad dat de patiënt de beste kans op herstel biedt.
 Onderzoek van de lymfeklieren in de hals / Bron: Istock.com/AlexRaths
Onderzoek van de lymfeklieren in de hals / Bron: Istock.com/AlexRathsOnderzoek en diagnose
De diagnose van lymfeklierkanker vereist een zorgvuldige en uitgebreide aanpak. De arts voert een reeks onderzoeken uit om vast te stellen of er sprake is van lymfoom en, zo ja, om welk type en stadium het gaat. Hieronder volgt een gedetailleerd overzicht van de meest voorkomende diagnostische stappen voor lymfeklierkanker, waarbij gebruik wordt gemaakt van verschillende technieken en technologieën.Anamnese en lichamelijk onderzoek
Het eerste diagnostische onderzoek begint met een uitgebreid anamnese- en lichamelijk onderzoek. De arts stelt vragen over de klachten, levensstijl, medische geschiedenis en familiegeschiedenis van de patiënt. Veelvoorkomende symptomen zoals opgezwollen lymfeklieren, onverklaard gewichtsverlies, nachtzweten en vermoeidheid worden besproken om een beeld te krijgen van de ernst en aard van de klachten.Vervolgens verricht de arts een lichamelijk onderzoek, waarbij hij controleert op zichtbare of voelbare zwellingen in de lymfeklieren, vooral in de nek, oksels en lies. Een vergrote lymfeklier betekent echter niet meteen dat er sprake is van kanker; meestal is het een reactie op een infectie. De arts let ook op andere tekenen, zoals vergrote milt of lever, wat kan wijzen op de verspreiding van lymfoomcellen.
Lymfeklierbiopsie
Om een definitieve diagnose te stellen, is vaak een lymfeklierbiopsie nodig. Bij deze procedure wordt een klein stukje weefsel uit een lymfeklier genomen voor onderzoek onder de microscoop. De patholoog bekijkt dit weefsel nauwkeurig om te controleren op abnormale cellen die kenmerkend zijn voor lymfoom, zoals de Reed-Sternberg-cel bij Hodgkinlymfoom.De biopsie kan op verschillende manieren worden uitgevoerd, afhankelijk van de locatie en grootte van de lymfeklier:
- Excisiebiopsie: Een hele lymfeklier wordt verwijderd.
- Naaldbiopsie: Een fijne of dikke naald wordt gebruikt om een kleine hoeveelheid weefsel uit de lymfeklier te halen.
Bloedonderzoek
Hoewel lymfoom niet rechtstreeks kan worden aangetoond in het bloed, kan bloedonderzoek nuttig zijn om andere aandoeningen uit te sluiten en inzicht te krijgen in de algemene gezondheidstoestand van de patiënt. Bij bloedonderzoek worden vaak de volgende aspecten beoordeeld:- Volledig bloedbeeld: Hiermee worden het aantal rode en witte bloedcellen en bloedplaatjes gemeten. Afwijkingen in deze waarden kunnen wijzen op beenmergbetrokkenheid.
- LDH (lactaatdehydrogenase): Verhoogde LDH-waarden kunnen duiden op actieve kankercellen en worden vaak gebruikt om de prognose te bepalen.
Beenmergaspiratie
Bij een beenmergaspiratie wordt een kleine hoeveelheid beenmerg weggezogen uit het sponsachtige deel van een bot, vaak uit het bekken. Dit onderzoek wordt uitgevoerd met een naald en is bedoeld om te controleren op de aanwezigheid van lymfoomcellen in het beenmerg. Beenmergbetrokkenheid kan invloed hebben op de behandeling en prognose, vooral bij agressieve vormen van non-Hodgkinlymfoom.Röntgenfoto van de borst
Een röntgenfoto van de borst biedt snelle beelden van de binnenkant van de borstkas en kan worden gebruikt om vergrote lymfeklieren of massa’s in het mediastinum (de ruimte tussen de longen) op te sporen. Dit onderzoek maakt gebruik van lage doses straling en kan helpen om een mogelijk lymfoom in de borstkas te detecteren. MRI-scan / Bron: Istock.com/© james steidl
MRI-scan / Bron: Istock.com/© james steidlMRI
Een MRI (Magnetic Resonance Imaging) gebruikt krachtige magneten en radiogolven om gedetailleerde beelden te maken van de organen en structuren in het lichaam. MRI is vooral nuttig om lymfoom te beoordelen in moeilijk zichtbare gebieden, zoals de hersenen of ruggenmerg. Dit beeldvormend onderzoek kan helpen bij het bepalen van de omvang van het lymfoom en de impact op omliggende weefsels.PET-scan
Een PET-scan (Positron Emissie Tomografie) maakt gebruik van een radioactieve stof om actieve kankercellen in het lichaam op te sporen. De patiënt krijgt een kleine hoeveelheid radioactieve suiker toegediend, die zich ophoopt in snel delende kankercellen. De PET-scan geeft vervolgens beelden van deze actieve plekken, wat helpt bij het in kaart brengen van de verspreiding van lymfoom in het lichaam.CT-scan
De CT-scan wordt vaak in combinatie met een PET-scan uitgevoerd en biedt gedetailleerde doorsnedefoto’s van het lichaam. Het helpt bij het lokaliseren van vergrote lymfeklieren en andere betrokken structuren, wat essentieel is voor stadiëring van het lymfoom en het plannen van de behandeling.Moleculaire testen
Bij moleculaire testen wordt gezocht naar specifieke genetische en moleculaire veranderingen in de kankercellen. Door mutaties in genen, eiwitten en andere moleculen te identificeren, kunnen artsen achterhalen welk subtype lymfoom aanwezig is. Dit helpt niet alleen bij de diagnose, maar ook bij het bepalen van de therapierespons. Moleculaire testen zijn vooral waardevol bij geavanceerde of zeldzame lymfomen, omdat ze vaak helpen bij het vinden van gerichte therapieën.Lymfeklierkanker behandeling
De behandeling van lymfeklierkanker, ofwel lymfoom, wordt afgestemd op het specifieke type lymfoom (Hodgkin of non-Hodgkin), het stadium van de kanker en de algehele gezondheid van de patiënt. De behandelingsopties zijn divers en kunnen worden gecombineerd om het beste resultaat te behalen. Van chemotherapie en bestraling tot geavanceerde immuuntherapie en stamceltransplantatie – de mogelijkheden zijn uitgebreider dan ooit.De belangrijkste behandelingen voor non-Hodgkinlymfoom (NHL) zijn gericht op het aanpakken van kankercellen die zich snel en ongeremd delen. De behandeling voor Hodgkinlymfoom (HL) bestaat meestal uit chemotherapie en bestraling, hoewel nieuwe therapieën ook hier hun intrede doen. Hieronder volgt een uitgebreide beschrijving van de behandelopties voor lymfeklierkanker.
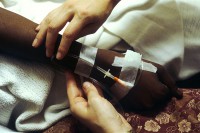 Chemotherapie bij lymfeklierkanker / Bron: Linda Bartlett, Wikimedia Commons (Publiek domein)
Chemotherapie bij lymfeklierkanker / Bron: Linda Bartlett, Wikimedia Commons (Publiek domein)Chemotherapie
Chemotherapie blijft een van de kernbehandelingen voor zowel Hodgkin als non-Hodgkinlymfoom. Deze behandeling maakt gebruik van krachtige geneesmiddelen om kankercellen te doden en hun verspreiding te stoppen. De medicijnen worden vaak intraveneus (via een infuus) toegediend en verspreiden zich door het hele lichaam, waardoor ze ook kankercellen buiten de lymfeklieren kunnen aanvallen.- Curatieve en palliatieve chemotherapie: Chemotherapie kan genezend (curatief) worden ingezet, maar ook om symptomen te verlichten (palliatief) bij niet-geneesbare vormen.
- Combinatie met andere therapieën: Chemotherapie wordt vaak gecombineerd met immunotherapie of radiotherapie om een zo krachtig mogelijk effect te bereiken.
Bestralingstherapie
Radiotherapie of bestralingstherapie gebruikt hoogenergetische straling om kankercellen te vernietigen. De straling wordt gericht op specifieke gebieden waar zich lymfeklierkanker bevindt en helpt om de grootte van tumoren te verkleinen en verdere verspreiding te voorkomen.- Gerichte aanpak: Vooral bij Hodgkinlymfoom in de beginfase kan bestraling zeer effectief zijn, omdat het zich beperkt tot de aangetaste lymfeklieren en de omliggende weefsels.
- Combinatietherapie: Vaak wordt radiotherapie gecombineerd met chemotherapie, vooral bij agressieve non-Hodgkinlymfomen en in gevorderde stadia van Hodgkinlymfoom.
Immunotherapie
Immunotherapie is een snel groeiende behandelmethode die het eigen immuunsysteem stimuleert om de kankercellen aan te vallen. Het lichaam leert hierdoor om de lymfoomcellen als gevaarlijk te herkennen en deze effectief te bestrijden.- Monoklonale antilichamen: Deze kunstmatig geproduceerde antilichamen hechten zich aan specifieke eiwitten op de kankercellen en markeren deze voor vernietiging door het immuunsysteem.
- CAR-T-celtherapie: Deze therapie, vooral bij agressieve non-Hodgkinlymfoom, is veelbelovend. Hierbij worden de T-cellen van de patiënt genetisch gemodificeerd om kankercellen gericht aan te vallen. Na de genetische aanpassing worden de T-cellen teruggeplaatst in het lichaam, waar ze gericht de kankercellen aanvallen.
Stamceltransplantatie
Wanneer chemotherapie en bestraling niet afdoende zijn, kan een stamceltransplantatie uitkomst bieden. Deze intensieve behandeling wordt vaak ingezet bij terugkerende of moeilijk te behandelen lymfomen. Eerst wordt het lichaam voorbereid met zeer hoge doses chemotherapie, die zowel de kankercellen als de stamcellen in het beenmerg vernietigen. Vervolgens krijgt de patiënt een transplantatie van stamcellen om het vernietigde beenmerg te vervangen en de aanmaak van bloedcellen te herstellen.- Autologe transplantatie: Hierbij worden de eigen stamcellen van de patiënt afgenomen, opgeslagen en na de chemotherapie weer teruggeplaatst. Dit is vooral effectief bij non-Hodgkinlymfoom.
- Allogene transplantatie: Hierbij worden stamcellen van een gezonde donor gebruikt. Deze behandeling biedt een nieuwe, gezonde aanmaak van bloedcellen, maar vereist wel een nauwkeurige donorselectie vanwege de risico's op afstoting.
Gerichte therapieën
Naast immunotherapie worden bij lymfeklierkanker steeds vaker gerichte therapieën gebruikt. Deze behandelingen richten zich op specifieke genetische of moleculaire afwijkingen in de kankercellen, waardoor gezonde cellen vaak ongemoeid blijven. Gerichte therapieën zijn doorgaans milder en hebben minder bijwerkingen dan chemotherapie.- Tyrosinekinaseremmers: Deze geneesmiddelen blokkeren bepaalde enzymen die betrokken zijn bij de groei en verspreiding van kankercellen. Ze worden vaak gebruikt bij lymfomen met specifieke genetische afwijkingen.
- Proteasoomremmers: Deze medicijnen remmen de afbraak van bepaalde eiwitten in kankercellen, wat leidt tot celdood. Proteasoomremmers zijn effectief bij enkele specifieke vormen van non-Hodgkinlymfoom.
Steroidtherapie
Steroidtherapie wordt vaak ingezet als ondersteunende therapie bij chemotherapie en radiotherapie. Steroïden verminderen ontsteking en zwelling en kunnen de effectiviteit van chemotherapie verhogen. Bij lymfeklierkanker worden steroïden soms ook gebruikt om de bijwerkingen van de behandeling te verlichten, zoals misselijkheid en ontsteking.Externe en experimentele behandelingen
Voor mensen bij wie conventionele therapieën niet aanslaan, zijn er ook mogelijkheden om deel te nemen aan klinische studies en experimentele behandelingen. Deze behandelingen onderzoeken de effectiviteit van nieuwe geneesmiddelen en behandelmethoden, en kunnen toegang bieden tot veelbelovende therapieën die nog niet op de markt zijn.- Klinische studies: In veel landen, waaronder Nederland en België, zijn er klinische studies gaande naar nieuwe behandelingen voor zowel Hodgkin- als non-Hodgkinlymfoom. Deze studies kunnen toegang bieden tot nieuwe geneesmiddelen zoals nog niet goedgekeurde immunotherapieën en genetische behandelingen.
- Gentherapie: In sommige gevallen kan gentherapie helpen om genetische mutaties te corrigeren die betrokken zijn bij de groei van kankercellen. Hoewel dit nog grotendeels experimenteel is, kan gentherapie in de toekomst een doorslaggevende rol spelen bij de behandeling van lymfoom.
Afstemmen van de behandeling
De keuze voor een behandeling wordt bepaald door het type lymfoom, de mate van agressiviteit, de locatie van de ziekte en de algehele gezondheid van de patiënt. Voor sommige patiënten kan een milde behandeling met chemotherapie voldoende zijn, terwijl anderen een combinatie van stamceltransplantatie en geavanceerde immunotherapie nodig hebben. Het multidisciplinaire behandelteam, dat bestaat uit oncologen, hematologen en radiotherapeuten, werkt samen om een op maat gemaakte behandelstrategie te ontwikkelen die het beste aansluit bij de behoeften en situatie van de patiënt.Met een breed scala aan therapieën en een toenemend aantal innovatieve behandelingen is de prognose voor veel patiënten met lymfeklierkanker de afgelopen jaren verbeterd. De keuze en volgorde van de therapieën wordt zorgvuldig afgestemd om de ziekte onder controle te krijgen en een zo hoog mogelijke levenskwaliteit te behouden.
Prognose en levensverwachting
De vooruitzichten voor HL zijn zeer goed. Het is een van de best te genezen vormen van kanker. De vijfjaarsoverleving na behandeling is anno 2025 88% voor alle vier stadia.[1]Als gevolg van betere behandelmethoden, zijn de vooruitzichten voor NHL aanzienlijk verbeterd in de afgelopen decennia. De toevoeging van immunotherapie aan de standaardbehandeling voor NHL, heeft een positief effect op de overlevingskansen en heeft de levensverwachting doen toenemen. Van alle mensen met non-hodgkinlymfomen is ruim 70% vijf jaar na het stellen van de diagnose nog in leven.[2]
Complicaties
Lymfeklierkanker brengt niet alleen de ziekte zelf met zich mee, maar ook een aantal mogelijke complicaties die zich tijdens of na de behandeling kunnen voordoen. Deze complicaties kunnen variëren van fysieke bijwerkingen en psychologische effecten tot immunologische en zelfs cardiovasculaire risico's. Sommige complicaties zijn een direct gevolg van de ziekte, terwijl andere ontstaan door intensieve therapieën zoals chemotherapie, bestraling en stamceltransplantaties. Hier volgt een overzicht van de meest voorkomende complicaties en hoe ze een rol spelen in het herstelproces.Infecties: een kwetsbaar immuunsysteem
Lymfeklierkanker tast het immuunsysteem rechtstreeks aan, en de behandelingen die nodig zijn om de kanker te bestrijden, verzwakken het vaak nog verder. Chemotherapie en bestraling vernietigen niet alleen kankercellen, maar ook gezonde immuuncellen, waardoor de patiënt vatbaar wordt voor infecties.
Voorbeeld: Een patiënt die chemotherapie ondergaat, kan te maken krijgen met bacteriële infecties die normaal door het immuunsysteem zouden worden bestreden. Voor velen betekent dit dat zelfs een simpele verkoudheid kan uitgroeien tot een ernstige longontsteking.
Verminderde bloedaanmaak: bloedarmoede, trombocytopenie en neutropenie
De intensieve behandelingen voor lymfeklierkanker kunnen het beenmerg aantasten, wat leidt tot een verminderde aanmaak van gezonde bloedcellen. Hierdoor kunnen verschillende problemen ontstaan:
- Bloedarmoede (anemie): Een laag aantal rode bloedcellen veroorzaakt vermoeidheid, bleekheid en kortademigheid.
- Trombocytopenie: Een tekort aan bloedplaatjes kan leiden tot gemakkelijk blauwe plekken en bloedingen.
- Neutropenie: Een laag aantal witte bloedcellen maakt het lichaam kwetsbaar voor infecties.
Voorbeeld: Na enkele cycli van chemotherapie kan een patiënt merken dat hij snel vermoeid raakt en bloedneusjes krijgt. Dit kan wijzen op een tekort aan rode bloedcellen en bloedplaatjes, wat het dagelijks leven bemoeilijkt.
Secundaire kankers: een onverwachte dreiging
Een minder bekende, maar ernstige complicatie is het verhoogde risico op secundaire kankers na intensieve behandelingen. Chemotherapie en bestraling kunnen namelijk ook genetische schade aan gezonde cellen veroorzaken, waardoor de kans op een andere vorm van kanker in de toekomst toeneemt.
Voorbeeld: Een patiënt die bestraling heeft ondergaan voor Hodgkinlymfoom kan later een verhoogd risico lopen op long- of borstkanker, vooral als bestraling in de borstregio heeft plaatsgevonden.
Hart- en vaatziekten: de stille belasting
Zowel chemotherapie als bestraling kan schade toebrengen aan het hart en de bloedvaten. Sommige chemotherapie-middelen kunnen de hartspier verzwakken, wat kan leiden tot cardiomyopathie, terwijl bestraling in de borstkas de bloedvaten kan aantasten.
Voorbeeld: Na jaren van behandeling kan een patiënt die een hoge dosis chemotherapie heeft gekregen, merken dat hij sneller buiten adem raakt en een zwakkere hartfunctie heeft. Dit kan een langetermijngevolg zijn van de behandeling.
Neuropathie: tintelingen en gevoelloosheid
Sommige chemotherapie-middelen kunnen zenuwschade veroorzaken, wat leidt tot neuropathie. Dit uit zich vaak in tintelingen, gevoelloosheid en zelfs pijn in de handen en voeten, wat het dagelijks functioneren kan belemmeren.
Voorbeeld: Patiënten kunnen merken dat ze moeite hebben om knopen vast te maken of gevoel verliezen in hun vingers en tenen, wat invloed heeft op hun motorische vaardigheden.
Psychische effecten: angst en depressie
De diagnose en behandeling van lymfeklierkanker kan emotioneel zwaar zijn. Angst voor terugval, vermoeidheid en het verlies van controle over het lichaam kunnen bijdragen aan psychische problemen zoals angst en depressie.
Voorbeeld: Een patiënt die hersteld is van Hodgkinlymfoom kan zich onzeker voelen over de toekomst en last krijgen van slapeloosheid door angst voor terugkeer van de ziekte. Psychologische begeleiding en ondersteuning kunnen hierbij van onschatbare waarde zijn.
Vermoeidheid: een allesoverheersende moeheid
Kankergerelateerde moeheid is een veelvoorkomende complicatie die lang kan aanhouden, zelfs na succesvolle behandeling. Deze vermoeidheid verschilt van normale vermoeidheid en kan zelfs door rust niet worden verlicht. Het is een diepgaande, voortdurende uitputting die alle aspecten van het leven beïnvloedt.
Voorbeeld: Een patiënt die weer aan het werk probeert te gaan, merkt dat hij halverwege de dag al uitgeput is en nauwelijks energie overhoudt om normale taken uit te voeren.
Lymfoedeem: zwelling door verstoorde lymfedrainage
Bij de behandeling van lymfeklierkanker kunnen lymfeklieren worden verwijderd of beschadigd, wat de lymfedrainage kan verstoren en leidt tot lymfoedeem. Dit is een pijnlijke zwelling, meestal in de armen of benen, die ontstaat doordat lymfevocht niet goed kan worden afgevoerd.
Voorbeeld: Een patiënt die een operatie heeft ondergaan waarbij lymfeklieren zijn verwijderd, kan later last krijgen van opgezwollen armen of benen. Lymfoedeem kan worden behandeld met fysiotherapie en compressieverbanden, maar blijft een terugkerend probleem.
Preventie
Lymfeklierkanker – het klinkt als iets dat ver weg van je bed gebeurt, maar wist je dat je zelf invloed kunt hebben op je risico? De exacte oorzaak is anno 2025 nog steeds een raadsel, maar wat we wél weten, is dat een gezonde leefstijl je kansen flink kan verbeteren. Geen rocket science, maar slimme keuzes maken voor je lichaam. Laten we het hebben over wat je kunt doen om jezelf te beschermen.Houd je immuunsysteem blij
Je lymfeklieren zijn de ridders van je immuunsysteem, dus zorg ervoor dat ze hun werk kunnen doen. Hoe? Begin bij je voeding. Denk aan kleurrijke groenten, sappig fruit, volkoren producten, en gezonde vetten zoals in avocado’s en zalm. Een soort buffet voor je cellen, vol antioxidanten die helpen schade te voorkomen.
En vergeet bewegen niet! Je hoeft echt geen marathons te rennen – al is dat natuurlijk top – maar dagelijks een wandeling of een rondje sporten geeft je immuunsysteem een boost. Het helpt je lichaam sterker te worden én verlaagt je stressniveau. Win-win!
 Stoppen met roken / Bron: Serhiy Kobyakov/Shutterstock.com
Stoppen met roken / Bron: Serhiy Kobyakov/Shutterstock.comSommige dingen kun je gewoon beter laten liggen. Roken bijvoorbeeld – die peuk lijkt onschuldig, maar je lymfesysteem wordt er niet blij van. Stoppen is lastig, maar oh zo de moeite waard. En let ook op met schadelijke stoffen, zoals chemicaliën op werk of thuis. Werk je met pesticiden of oplosmiddelen? Gebruik handschoenen, een masker, en bescherm jezelf.
En hey, vergeet de zon niet. UV-straling kan je huid belasten en indirect je lymfesysteem. Dus smeer je in, zoek wat schaduw op, en blijf een beetje slim in de zon. Niemand houdt van een verbrande neus, toch?
Luister naar je lijf
Weet je wat écht belangrijk is? Je lichaam leren kennen en ernaar luisteren. Langdurige zwellingen, onverklaarbare koorts, nachtzweten of een plotseling gewichtsverlies? Dat zijn signalen waar je niet mee moet rondlopen. Ga naar je arts en laat het checken. Vroeg erbij zijn maakt een wereld van verschil.
Stress? Houd het in toom!
Stress is als een sluipmoordenaar voor je immuunsysteem. Of het nu werkdruk is of gewoon te veel dingen aan je hoofd – neem tijd voor jezelf. Doe intspanningsoefeningen, binge je favoriete serie, of maak een wandeling met je hond. Alles wat je helpt ontspannen, helpt ook je lichaam. Een relaxed lijf is een weerbaar lijf.
Preventie is geen magie, maar keuzes maken
Je hebt geen glazen bol nodig om te weten dat gezond leven je altijd een stap vooruit helpt. Door goed te eten, genoeg te bewegen, en risico’s te vermijden, geef je jezelf de beste kans. Het is geen garantie, maar hey, waarom zou je niet alles doen om je lichaam een voorsprong te geven? Begin klein, denk groot – jouw gezondheid is het waard!
Noten:
- Cancer.org. Survival Rates for Hodgkin Lymphoma. https://www.cancer.org/cancer/hodgkin-lymphoma/detection-diagnosis-staging/survival-rates.html (ingezien op 24-8-2022)
- VZ Info. Non-hodgkinlymfomen (NHL) | Sterfte en overleving. https://www.vzinfo.nl/non-hodgkin-lymfomen-nhl/sterfte-en-overleving (ingezien op 24-8-2022)
Lees verder
© 2017 - 2025 Tartuffel, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Deze informatie is van informatieve aard en geen vervanging voor professioneel medisch advies. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Lymfeklierkanker (maligne lymfoom)Lymfeklierkanker (maligne of kwaadaardig lymfoom) is een type kanker waarbij kwaadaardige witte bloedcellen - ofwel lymf…
Lymfeklierkanker (maligne lymfoom)Lymfeklierkanker (maligne of kwaadaardig lymfoom) is een type kanker waarbij kwaadaardige witte bloedcellen - ofwel lymf…
 Lymfeklierontsteking of lymfeknoopontstekingLymfeklieren of lymfeknopen maken onderdeel uit van het lymfevaatstelsel. Dit stelsel speelt een belangrijke rol in ons…
Lymfeklierontsteking of lymfeknoopontstekingLymfeklieren of lymfeknopen maken onderdeel uit van het lymfevaatstelsel. Dit stelsel speelt een belangrijke rol in ons…
 Knobbelige of korrelige massa in lies of bovenbeenVoel je een knobbelige of korrelige massa in de lies of aan de binnenkant van het bovenbeen dan gaat dit veelal om opgez…
Knobbelige of korrelige massa in lies of bovenbeenVoel je een knobbelige of korrelige massa in de lies of aan de binnenkant van het bovenbeen dan gaat dit veelal om opgez…
 Burkitt-lymfoom: agressieve snel groeiende lymfeklierkankerBij het Non-Hodgkin-lymfoom ontstaat ongewone celdeling in de lymfeklieren, waarbij na verloop van tijd het lymfesysteem…
Burkitt-lymfoom: agressieve snel groeiende lymfeklierkankerBij het Non-Hodgkin-lymfoom ontstaat ongewone celdeling in de lymfeklieren, waarbij na verloop van tijd het lymfesysteem…
 Septische artritis: Ontsteking van gewricht door infectieSeptische artritis is een ontsteking van een gewricht veroorzaakt door bacteriën, virussen of schimmels. Deze pathogenen…
Septische artritis: Ontsteking van gewricht door infectieSeptische artritis is een ontsteking van een gewricht veroorzaakt door bacteriën, virussen of schimmels. Deze pathogenen…
 Vaginaal bloedverlies: oorzaken abnormale bloedingenVaginaal bloedverlies komt frequent voor. Abnormaal vaginaal bloedverlies duidt op overvloedig, tussentijds of onregelma…
Vaginaal bloedverlies: oorzaken abnormale bloedingenVaginaal bloedverlies komt frequent voor. Abnormaal vaginaal bloedverlies duidt op overvloedig, tussentijds of onregelma…
Gerelateerde artikelen
Bronnen en referenties
- Inleidingsfoto: Istock.com/AW
- Cancer.org. Survival Rates for Hodgkin Lymphoma. https://www.cancer.org/cancer/hodgkin-lymphoma/detection-diagnosis-staging/survival-rates.html (ingezien op 24-8-2022)
- C.J.H. van de Velde et al (red.): Oncologie; achtste herziene druk, Bohn Stafleu van Loghum, 2011.
- Hematologie Wijzer. Wat is non-Hodgkin lymfoom? https://www.hematologie-wijzer.nl/home/patient/informatie-voor-patienten/voorlichting/ziektebeelden/nhl/nhl (ingezien op 24-8-2022)
- https://www.olvg.nl/afdelingen/oncologisch_centrum_amsterdam/vormen_van_kanker/lymfeklierkanker
- https://nl.wikipedia.org/wiki/Maligne_lymfoom
- http://www.cancer.org/cancer/lymphoma/
- http://www.macmillan.org.uk/information-and-support/lymphoma
- https://hematologiegroningen.nl/patienten/content/3NHL.htm
- Martin Sulman. Mens & Gezondheid. https://mens-en-gezondheid.nl/ (ingezien op 6-11-2024 en 3-1-2025)
- Patientsengage. Prevention of lymphoma. https://www.patientsengage.com/conditions/lymphoma/prevention (ingezien op 27-6-2018)
- VZ Info. Non-hodgkinlymfomen (NHL) | Sterfte en overleving. https://www.vzinfo.nl/non-hodgkin-lymfomen-nhl/sterfte-en-overleving (ingezien op 24-8-2022)
- Afbeelding bron 1: Blausen Medical Communications, Inc., Wikimedia Commons (CC BY-3.0)
- Afbeelding bron 2: Istock.com/warrengoldswain
- Afbeelding bron 3: National Cancer Institute, Wikimedia Commons (Publiek domein)
- Afbeelding bron 4: Istock.com/VladimirFLoyd
- Afbeelding bron 5: Istock.com/Wavebreakmedia
- Afbeelding bron 6: Istock.com/AlexRaths
- Afbeelding bron 7: Istock.com/© james steidl
- Afbeelding bron 8: Linda Bartlett, Wikimedia Commons (Publiek domein)
- Afbeelding bron 9: Serhiy Kobyakov/Shutterstock.com
Tartuffel (2.971 artikelen)
Laatste update: 03-01-2025
Rubriek: Mens en Gezondheid
Subrubriek: Aandoeningen
Bronnen en referenties: 21
Laatste update: 03-01-2025
Rubriek: Mens en Gezondheid
Subrubriek: Aandoeningen
Bronnen en referenties: 21
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.
Medische informatie…
Deze informatie is van informatieve aard en geen vervanging voor professioneel medisch advies. Raadpleeg bij medische problemen en/of vragen altijd een arts.
Deze informatie is van informatieve aard en geen vervanging voor professioneel medisch advies. Raadpleeg bij medische problemen en/of vragen altijd een arts.